题目内容
【题目】学校某兴趣小组做了氧化铜和盐酸反应的实验,小明为测定反应后混合溶液的成分及含量,向烧杯中分5次共加入200克10%的氢氧化钠溶液,得到沉淀的质量记录如下:
加入NaOH溶液的质量/克 | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
生成沉淀的质量/克 | 0.0 | 2.45 | 7.35 | 9.8 | 9.8 |
(1)分析实验过程,第一次加入40.0克NaOH,为什么没有生成沉淀?_____。
(2)分析实验过程,如果加入90克NaOH,溶液中的溶质是_____。
(3)原来混合液中氯化铜的质量为多少克_____?(写出具体计算过程)
(4)若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会造成就计算氯化铜的含量_____。
A 偏高 B 偏低 C 不变
【答案】溶液为盐酸和氯化铜的混合溶液 氯化铜和氯化钠 13.5g A
【解析】
(1)溶液为盐酸和氯化铜的混合溶液,加入氢氧化钠溶液后,氢氧化钠先和盐酸反应,所以开始无沉淀,故填溶液为盐酸和氯化铜的混合溶液。
(2)由图可知,加入160g氢氧化钠溶液时才完全反应,所以加入90克NaOH,溶液中的溶质是剩余的氯化铜和生成的氯化钠,故填氯化铜和氯化钠。
(3)解:设原来混合液中氯化铜的质量为x
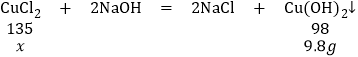
135:98=x:9.8g
x=13.5g
答:原来混合液中氯化铜的质量为13.5g。
(4)若小明在称量沉淀前,没有将沉淀上吸附的溶质清洗掉就直接干燥,则会导致沉淀质量偏大,则会造成就计算氯化铜的含量偏高,故填A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目