题目内容
【题目】化学小组为探究铁、铜、锌、银的金属活动性顺序,设计如下三个实验(其中金属均已打磨,其形状、大小及同种稀盐酸的用量均相同):
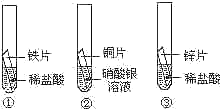
(1)实验②的现象为_______________.化学方程式________________.
(2)甲同学认为通过实验(1)和(3)可比较锌和铁的金属活动性,他依据的实验现象是___________.
![]()
(3)乙、丙两位同学认为上述实验方案不足以得出四种金属的活动性顺序,并在上述实验的基上,利用金属不同的化学性质分别补充了一个实验(如图所示),都实现了探究目的,乙同学的实验:X是金属_______,Y是______溶液;丙同学的实验:X是金属______,Y是______溶液.
【答案】铜片表面有银白色固体附着,溶液由无色变成蓝色 Cu +2AgNO3 == 2Ag+ Cu(NO3)2 锌表面产生气泡快,铁表面产生气泡慢 铁 硫酸铜 铜 硫酸亚铁
【解析】
(1)实验②的反应为铜和硝酸银反应生成硝酸铜和银,银是银白色固体,现象为铜片表面有银白色固体附着,溶液由无色变成蓝色,化学方程式:Cu +2AgNO3 == 2Ag+ Cu(NO3)2;
(2)排在氢前面的金属能与酸反应放出氢气,并且金属越活泼与酸反应就越剧烈,产生的气泡就越快,甲同学认为通过实验(1)和(3)可比较锌和铁的金属活动性,他依据的实验现象是锌表面产生气泡快,铁表面产生气泡慢;
(3)上述三个试管中 发生的化学反应证明锌>铁>氢>,铜>银,但铜与铁的活动性强弱不能证明,因此要加一个实验来证明,可以直接用金属与盐溶液反应,也可通过与酸反应证明。乙同学的实验:X是金属铁,Y是硫酸铜溶液;丙同学的实验:X是金属铜,Y是硫酸亚铁溶液。

 名校练考卷期末冲刺卷系列答案
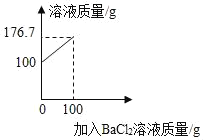
名校练考卷期末冲刺卷系列答案【题目】列表和作图是常用的数据处理方法.结合所绘图表判断下列说法正确的是( )
氢氧化钠、碳酸钠分别在水、酒精中的溶解度
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |
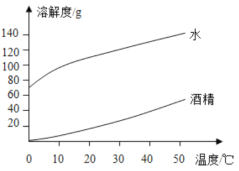
A.图象与表格均能反映温度对固体物质溶解度的影响,其中表格的优点是变化规律更直观
B.由表格数据可知,物质的溶解度只受温度影响
C.40℃时,将50g NaOH分别投入到100g水和酒精中都能得到饱和溶液
D.40℃时,将CO2通入饱和的NaOH酒精溶液中有沉淀生成