题目内容
【题目】计算题:
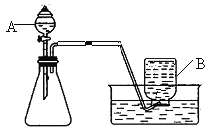
已知6.2克氯酸钾和二氧化锰的混合物,充分加热后剩余固体的质量为4.28克。求:
(1)生成多少克的氧气?_______________
(2)原混合物中有多少克的氯酸钾?_______________
(3)剩余固体有哪些物质组成?质量为多少?_______________
【答案】 1.92g 氯酸钾质量为4.9g 剩余固体中有MnO2 、KCl两种物质 ,MnO2质量为6.2g -4.9g =1.3g ,KCl质量为 4.28g -1.3g =2.98g
【解析】(1)根据质量守恒定律可知,生成![]() 的质量即为物质减少的质量,所以生成氧气的质量为:6.2g-4.28=1.92g;(2)原混合物中氯酸钾的质量可以通过生成氧气的质量来算得;(3)因为在此反应中二氧化锰作为催化剂,在反应前后质量和化学性质都不变可知剩余固体的组成为:
的质量即为物质减少的质量,所以生成氧气的质量为:6.2g-4.28=1.92g;(2)原混合物中氯酸钾的质量可以通过生成氧气的质量来算得;(3)因为在此反应中二氧化锰作为催化剂,在反应前后质量和化学性质都不变可知剩余固体的组成为: ![]() 、
、![]() ;
;
原混合物中氯酸钾的质量可设为![]() ,
,
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() =4.9g
=4.9g
所以原混合物中有氯酸钾4.9g,剩余固体中二氧化锰的质量为 6.2g-4.9g=1.3g, ![]() 的质量为4.28g-1.3g=2.98g。
的质量为4.28g-1.3g=2.98g。

练习册系列答案
相关题目