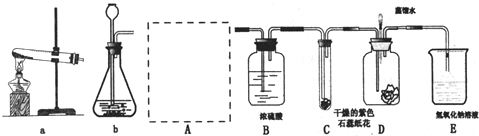
题目内容
亚硫酸钠(Na2SO3)在生活中可作防腐剂,在印染工业作为脱氧剂和漂白剂,现在实验存放较久的白色亚硫酸钠,学校的化学兴趣小组对它的成份进行探究.
查阅资料:
1亚硫酸钠在空气中易氧化成硫酸钠,不与二氧化碳反应
2亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性
3亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠
4亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀
小芳阅读了上述的资料后,对这瓶白色固体进行了猜想与探究
猜想:
a白色粉末只有Na2SO3
b白色粉末只有
c白色粉末是Na2SO3与Na2SO4的混合物
为了验证b的猜想,小芳选取了无色酚酞溶液、氯化钡溶液、稀硝酸中的一种进行以下探究,请帮她完成.
为进一步验证该白色粉末的组成,小麦做了以下的实验:
查阅资料:
1亚硫酸钠在空气中易氧化成硫酸钠,不与二氧化碳反应
2亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性
3亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠
4亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀
小芳阅读了上述的资料后,对这瓶白色固体进行了猜想与探究
猜想:
a白色粉末只有Na2SO3
b白色粉末只有
Na2SO4
Na2SO4
c白色粉末是Na2SO3与Na2SO4的混合物
为了验证b的猜想,小芳选取了无色酚酞溶液、氯化钡溶液、稀硝酸中的一种进行以下探究,请帮她完成.
| 实验操作 | 现象 | 结论 |
| 取样品置于烧杯中,加入 无色酚酞溶液 无色酚酞溶液 ; |
无色酚酞溶液变红色 无色酚酞溶液变红色 ; |
猜想b不成立 |
| 实验操作 | 现象 | 结论 |
| 取14.6g的白色固体,加入 稀盐酸 稀盐酸 ; |
有气体产生 | 证明白色固体肯定含有 Na2SO3 Na2SO3 ;可能含有 Na2SO4 Na2SO4 . |
| 把上述气体通入氢氧化钠溶液中,测得其增重6.4g | 确认白色固体是 Na2SO3和Na2SO4的混合物 Na2SO3和Na2SO4的混合物 . |
分析:猜想:根据信息“亚硫酸钠在空气中易氧化成硫酸钠,不与二氧化碳反应”分析白色粉末的组成;
小芳的实验:根据题中信息“亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性”和实验结论推断实验操作和现象;
小麦的实验:根据题中信息“亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠;亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀”和现象推断实验操作和结论.
小芳的实验:根据题中信息“亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性”和实验结论推断实验操作和现象;
小麦的实验:根据题中信息“亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠;亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀”和现象推断实验操作和结论.
解答:解:猜想:b根据信息“亚硫酸钠在空气中易氧化成硫酸钠,不与二氧化碳反应”可知白色粉末可能只有Na2SO3,或只有Na2SO4,或是Na2SO3与Na2SO4的混合物,故答案为:Na2SO4;
小芳的实验:根据题中信息“亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性”和实验结论“猜想b不成立”以及提供的药品可知实验操作是取样品置于烧杯中,加入无色酚酞溶液;现象是无色酚酞溶液变红色,故答案为:
小麦的实验:根据题中信息“亚硫酸钠与盐酸反应能生成盐、水和二氧化硫,与硝酸反应会氧化成硫酸钠;亚硫酸钠与可溶性的钙、钡盐反应会产生白色沉淀”和现象“有气体产生”可知加入的是稀盐酸,证明白色固体肯定含有Na2SO3,可能含有 Na2SO4;又因为“把上述气体通入氢氧化钠溶液中,测得其增重6.4g”,说明生成了6.4g二氧化硫,设14.6g的白色固体中亚硫酸钠的质量为x,
Na2SO3+2HCl═2NaCl+SO2↑+H2O
126 64
x 6.4g
=
解得:x=12.6g
因此可以确认白色固体是Na2SO3和Na2SO4的混合物,故答案为:
小芳的实验:根据题中信息“亚硫酸钠溶液呈碱性,硫酸钠溶液呈中性”和实验结论“猜想b不成立”以及提供的药品可知实验操作是取样品置于烧杯中,加入无色酚酞溶液;现象是无色酚酞溶液变红色,故答案为:
| 实验操作 | 现象 | 结论 |
| 无色酚酞溶液 | 无色酚酞溶液变红色 |
Na2SO3+2HCl═2NaCl+SO2↑+H2O
126 64
x 6.4g
| 126 |
| x |
| 64 |
| 6.4g |
解得:x=12.6g
因此可以确认白色固体是Na2SO3和Na2SO4的混合物,故答案为:
| 实验操作 | 现象 | 结论 |
| 稀盐酸 | Na2SO3;Na2SO4; | |
| Na2SO3和Na2SO4的混合物 |
点评:本题考查了学生利用题中信息结合已学知识探究分析问题的能力,只要认真分析,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目