题目内容
 (2012?润州区二模)油价的持续“高烧”和环境问题,国家决定推广乙醇汽油的使应用.
(2012?润州区二模)油价的持续“高烧”和环境问题,国家决定推广乙醇汽油的使应用.(1)某同学对乙醇溶液是否呈现碱性产生了兴趣:
[提出问题]乙醇化学式为C2H5OH,含有“氢氧根”,所以猜测它的水溶液应该显碱性.
[实验设计及操作1]取乙醇溶液少量于试管中,滴加无色酚酞溶液,观察到溶液为
无
无
色,则说明乙醇溶液不显碱性.为什么乙醇溶液不呈现碱性呢?[解释与结论]通过乙醇溶液的导电性实验,可知乙醇溶液几乎不导电.说明乙醇溶液中不含自由移动的离子,即不含
OH-
OH-
(写出离子符号),所以乙醇溶液不显碱性.(2)I.乙醇燃烧时如果氧气量不足,可能还有CO生成.用以下装置确证乙醇燃烧产物有CO和CO2,应将乙醇燃烧后的产物依次通过(按气流从左至右顺序填装置编号)
②①③
②①③
,正确连接后的装置仍存在不足,请指出其不足之处尾气没有处理
尾气没有处理
.
| 编号 | ① | ② | ③ |
| 装置 |  |
 |
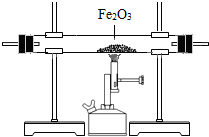 |
吸收混合气体中的二氧化碳
吸收混合气体中的二氧化碳
;写出装置①中所盛溶液名称是浓硫酸
浓硫酸
,写出③中发生反应的化学方程式3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||
III.与乙醇结构相似的化合物还有甲醇(CH3OH)、丙醇(C3H7OH)、丁醇(C4H9OH)…等,这类物质称为醇类,则含8个碳原子的醇的化学式为
C8H17OH
C8H17OH
.分析:(1)[实验设计及操作1]
显碱性的溶液能使酚酞试液变红色;
[解释与结论]
如果溶液中含有氢氧根离子,则溶液显碱性;
(2)I.二氧化碳能使澄清的石灰水变浑浊,浓硫酸具有吸水性,一氧化碳能够还原某些金属氧化物;
II.氢氧化钠溶液能够吸收二氧化碳气体,根据反应物、生成物、反应条件及其质量守恒定律可以书写化学方程式;
III.根据某些物质的化学式可以类推一类物质的化学式.
显碱性的溶液能使酚酞试液变红色;
[解释与结论]
如果溶液中含有氢氧根离子,则溶液显碱性;
(2)I.二氧化碳能使澄清的石灰水变浑浊,浓硫酸具有吸水性,一氧化碳能够还原某些金属氧化物;
II.氢氧化钠溶液能够吸收二氧化碳气体,根据反应物、生成物、反应条件及其质量守恒定律可以书写化学方程式;
III.根据某些物质的化学式可以类推一类物质的化学式.
解答:解:(1)[实验设计及操作1]
乙醇溶液不显碱性,向乙醇溶液中滴加无色的酚酞试液时,酚酞试液不变色.
故填:无.
[解释与结论]
乙醇在溶液中以分子形式存在,所以乙醇溶液中不含有自由移动的离子,即不含氢氧根离子,所以乙醇溶液不显碱性,氢氧根离子的符号是OH-.
故填:OH-.
(2)I.因为一氧化碳和氧化铁反应能生成二氧化碳,所以应该先验证二氧化碳,②中的石灰水可以检验二氧化碳的存在,然后除去水蒸气,用浓硫酸可以除去水蒸气,①中应该是浓硫酸,再把气体通入③装置中验证一氧化碳的存在;整个装置的不足之处是没有处理尾气.
故填:②①③;尾气没有处理.
II.装置②中氢氧化钠溶液的作用是吸收混合气体中的二氧化碳,①中所盛溶液应该是浓硫酸,一氧化碳和氧化铁在高温条件下反应的化学方程式为:
3CO+Fe2O3
2Fe+3CO2.
故填:吸收混合气体中的二氧化碳;浓硫酸;3CO+Fe2O3
2Fe+3CO2.
III.由CH3OH、C3H7OH、C4H9OH等的化学式可知,每个分子除含有一个OH外,还含有碳原子和氢原子,氢原子的个数比碳原子个数的2倍还多1个,所以含8个碳原子的醇的化学式为C8H17OH.
故填:C8H17OH.
乙醇溶液不显碱性,向乙醇溶液中滴加无色的酚酞试液时,酚酞试液不变色.
故填:无.
[解释与结论]
乙醇在溶液中以分子形式存在,所以乙醇溶液中不含有自由移动的离子,即不含氢氧根离子,所以乙醇溶液不显碱性,氢氧根离子的符号是OH-.
故填:OH-.
(2)I.因为一氧化碳和氧化铁反应能生成二氧化碳,所以应该先验证二氧化碳,②中的石灰水可以检验二氧化碳的存在,然后除去水蒸气,用浓硫酸可以除去水蒸气,①中应该是浓硫酸,再把气体通入③装置中验证一氧化碳的存在;整个装置的不足之处是没有处理尾气.
故填:②①③;尾气没有处理.
II.装置②中氢氧化钠溶液的作用是吸收混合气体中的二氧化碳,①中所盛溶液应该是浓硫酸,一氧化碳和氧化铁在高温条件下反应的化学方程式为:
3CO+Fe2O3
| ||
故填:吸收混合气体中的二氧化碳;浓硫酸;3CO+Fe2O3
| ||
III.由CH3OH、C3H7OH、C4H9OH等的化学式可知,每个分子除含有一个OH外,还含有碳原子和氢原子,氢原子的个数比碳原子个数的2倍还多1个,所以含8个碳原子的醇的化学式为C8H17OH.
故填:C8H17OH.
点评:类推法是一种重要的解题方法,要善于发现问题、分析问题,例如推导醇的化学式就是一个例证.

练习册系列答案
相关题目