题目内容
【题目】甲、乙两种固体物质的溶解度曲线如图所示.判断下列叙述是否正确,将错误改正 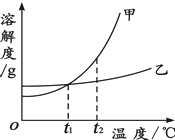
A.t1℃时,甲和乙溶液中溶质的质量分数一定相等
B.t2℃时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲
C.将甲、乙的饱和溶液从t2℃降温至t1℃,析出晶体的质量甲比乙多
D.用降温的方法一定能使甲的不饱和溶液变成饱和溶液 .
【答案】错误;t1℃时,甲和乙饱和溶液中溶质的质量分数一定相等;正确;错误;将等质量的甲、乙的饱和溶液从t2℃降温至t1℃,析出晶体的质量甲比乙多;错误;用降温的方法不一定能使甲的不饱和溶液变成饱和溶液
【解析】解:A、不知溶液中溶质、溶剂的质量多少,无法判断溶质的质量分数是否相等;据饱和时质量分数的计算式 ![]() ×100%可知:若两溶液是饱和溶液,该温度下二者的溶解度相等,则溶质的质量分数相等; B、t2℃时甲的溶解度大于乙,即等质量的水中溶解的甲大于乙,所以用等质量的甲和乙固体配制饱和溶液,需要水的质量甲小于乙,得到乙溶液的质量大于甲;
×100%可知:若两溶液是饱和溶液,该温度下二者的溶解度相等,则溶质的质量分数相等; B、t2℃时甲的溶解度大于乙,即等质量的水中溶解的甲大于乙,所以用等质量的甲和乙固体配制饱和溶液,需要水的质量甲小于乙,得到乙溶液的质量大于甲;
C、等质量的饱和溶液降低相同的温度,溶解度变化大的析出晶体多,本题中甲、乙的饱和溶液的质量不能确定,所以无法判断析出晶体的到多少;
D、氢氧化钙的溶解度随温度的降低而减小,所以不能用降温的方法一定能使甲的不饱和溶液变成饱和溶液.
所以答案是:A、错误;t1℃时,甲和乙饱和溶液中溶质的质量分数一定相等;
B、正确;
C、错误;将等质量的甲、乙的饱和溶液从t2℃降温至t1℃,析出晶体的质量甲比乙多;
D、错误;用降温的方法不一定能使甲的不饱和溶液变成饱和溶液.
【考点精析】掌握饱和溶液和不饱和溶液相互转变的方法和固体溶解度曲线及其作用是解答本题的根本,需要知道饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

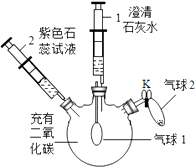
【题目】某同学利用如图装置验证二氧化碳的相关化学性质.
实验装置 | 实验步骤 | 实验现象 |
| ①向外拉注射器1 | 气球1微微鼓起,注射器1中溶液变浑浊 |
②将注射器2中的液体推入瓶中 | 气球1继续微微鼓起,… | |
③打开K,将气球2中的固体氢氧化钠倒入瓶中后,关闭K | 气球1继续变大,… |
(1)步骤①中发生反应的化学方程式是 .
(2)补全步骤②中的现象: .
(3)补全步骤③中的现象: , 其中“气球1继续变大”的原因是 .
(4)通过本实验能验证的二氧化碳的化学性质是 .