题目内容
【题目】白云石粉是一种生产高级玻璃器皿、医药用瓶、光学玻璃的原料,某化学兴趣小组对白云石粉极其好奇,决定对其进行探究.
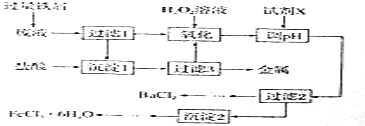
【查阅资料】白云石属于碳酸盐矿物,白云石粉主要成分的化学式可表示为:xMgCO3yCaCO3 . ( 杂质是二氧化硅,其不溶于水,也不与盐酸反应,受热不分解)
一:定性探究:白云石粉的成分和性质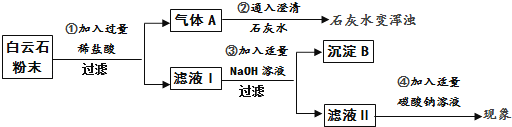
(1)【实验分析】
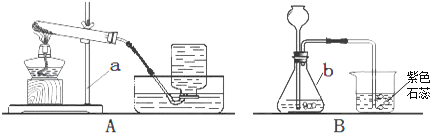
①过滤操作中用到的玻璃仪器有玻璃棒、烧杯、 .
②由步骤①②的现象可得出白云石粉中一定含有的离子是(填离子符号).
③步骤③生成氢氧化镁的化学方程式是 . 步骤④的反应现象是 .
【结论】综合上述实验现象可初步证明白云石由碳酸钙、碳酸镁组成.
(2)[实验质疑】小组同学经过讨论认为:因氢氧化钙微溶于水,导致沉淀B中除了氢氧化镁之外应该还混有氢氧化钙,对定量测定白云石粉的组成干扰较大,在老师的指导下该兴趣小组采用热分解法进行定量探究.
二:定量探究:白云石的组成
[查阅资料】碳酸钙开始分解的温度为898℃,1000℃时完全分解生成生石灰和二氧化碳气体;碳酸钙与碳酸镁的化学性质相似;碳酸镁开始分解的温度为540℃,700℃时完全分解.
【实验设计】为测定白云石中的含钙量及x:y的值,该兴趣小组设计了如下装置并进行实验: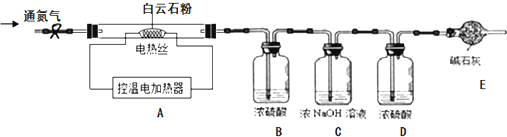
【实验步骤】①组装仪器,检查装置的气密性;②准确称取15.0g 白云石粉末放在A装置中,打开弹簧夹,鼓入一段时间氮气,称量B、C、D装置的质量;③关闭弹簧夹,打开控温电加热器,缓缓调升温度至700℃,持续加热至固体质量不变;④打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量;⑤关闭弹簧夹,调升温度至1000℃,持续加热至固体质量不变,打开弹簧夹,缓缓鼓入一段时间氮气,准确称量B、C、D装置的质量.
实验数据记录如表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | |
反应前 | 50.0 | 100.0 | 50.0 |
700℃ | 50.0 | 102.1 | 50.1 |
1000℃ | 50.0 | 106.3 | 50.3 |
【实验分析和数据处理】
①装置D的作用是什么?
②持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是什么?
③计算白云石中钙元素的质量分数.(写出计算过程,结果保留小数点后一位):
④设计实验证明白云石粉已完全分解的实验方法是什么(写出实验方法、现象、结论)
⑤白云石(xMgCO3yCaCO3)中的x:y= (最简整数比),若加热前没有鼓入一段时间的氮气,将会导致x:y的值 (填偏大、偏小或不变).
【答案】
(1)漏斗;CO32﹣;MgCl2+2NaOH═Mg(OH)2↓+2NaCl;产生白色沉淀
(2)
①吸收氮气带出的水蒸气,防止测得二氧化碳的质量偏小.
②使残留在装置内的二氧化碳气体全部被C装置吸收.
③设碳酸钙的质量为x,
碳酸钙分解生成二氧化碳质量是4.4g,
CaCO3![]() CaO+CO2↑,
CaO+CO2↑,
100 44
x 4.4g
![]()
x=10g,
10g碳酸钙中钙元素质量为:10g× ![]() ×100%=4g,白云石中钙元素的质量分数为:
×100%=4g,白云石中钙元素的质量分数为: ![]() ×100%=26.7%,
×100%=26.7%,
答:白云石中钙元素的质量分数为26.7%.
④取少量反应后固体于试管中,加入足量的稀盐酸,无气泡产生,说明完全分解.
⑤1:2;偏大.
【解析】解:(1)过滤操作中用到的玻璃仪器有玻璃棒、烧杯、漏斗.
故填:漏斗.碳酸根离子能和氢离子结合成水和二氧化碳,因此由步骤①②的现象可得出白云石粉中一定含有的离子是CO32﹣ .
故填:CO32﹣ . 步骤③中,氯化镁和氢氧化钠反应生成白色沉淀氢氧化镁和氯化钠,反应的化学方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
氯化钙能和碳酸钠反应生成白色沉淀碳酸钙和氯化钠,实验现象是产生白色沉淀.
故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;产生白色沉淀.①装置D的作用是吸收氮气带出的水蒸气,防止测得二氧化碳的质量偏小.故填:吸收氮气带出的水蒸气,防止测得二氧化碳的质量偏小.②持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是使残留在装置内的二氧化碳气体全部被C装置吸收.故填:使残留在装置内的二氧化碳气体全部被C装置吸收.
③设碳酸钙的质量为x,
碳酸钙分解生成二氧化碳质量是4.4g,
CaCO3![]() CaO+CO2↑,
CaO+CO2↑,
100 44
x 4.4g![]() =
= ![]() ,
,
x=10g,
10g碳酸钙中钙元素质量为:10g× ![]() ×100%=4g,白云石中钙元素的质量分数为:
×100%=4g,白云石中钙元素的质量分数为: ![]() ×100%=26.7%,
×100%=26.7%,
答:白云石中钙元素的质量分数为26.7%.
④实验证明白云石粉已完全分解的实验方法是:取少量反应后固体于试管中,加入足量的稀盐酸,无气泡产生,说明完全分解.
故填:取少量反应后固体于试管中,加入足量的稀盐酸,无气泡产生,说明完全分解.
⑤设碳酸镁质量为y,
碳酸镁分解生成二氧化碳的质量是2.2g,
MgCO3![]() MgO+CO2↑,
MgO+CO2↑,
84 44
y 2.2g![]() =
= ![]() ,
,
y=4.2g,
根据题意有: ![]() =
= ![]() ,
,![]() =
= ![]() ,
,
若加热前没有鼓入一段时间的氮气,或导致碳酸镁分解生成的二氧化碳质量偏大,从而会导致x:y的值偏大.
故填:1:2;偏大.
(1)过滤操作中用到的玻璃仪器有玻璃棒、烧杯和漏斗;碳酸根离子能和氢离子结合成水和二氧化碳;步骤③中,氯化镁和氢氧化钠反应生成白色沉淀氢氧化镁和氯化钠;
氯化钙能和碳酸钠反应生成白色沉淀碳酸钙和氯化钠;装置D的作用是吸收氮气带出的水蒸气,防止测得二氧化碳的质量偏小;持续加热至固体质量不变后缓缓鼓入一段时间氮气的目的是使残留在装置内的二氧化碳气体全部被C装置吸收;根据反应生成二氧化碳的质量可以计算碳酸钙的质量,进一步可以计算白云石中钙元素的质量分数;设计实验证明白云石粉已完全分解的实验方法是:取少量反应后固体于试管中,加入足量的稀盐酸,无气泡产生,说明完全分解;根据碳酸镁和碳酸钙的质量可以计算白云石(xMgCO3yCaCO3)中的 x:y的值.