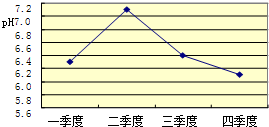
题目内容
经过一年化学知识的学习,我们可以初步认识到:化学反应的快慢、现象、生成物等与反应物的量有着密切关系。请各举一例说明:
(1)反应物的量不同,生成物可能不同 。
(2)反应物的量不同,反应现象可能不同 。
(3)反应温度不同,反应速率可能不同 。
【解析】化学反应的影响因素很多。反应条件、反应物的浓度、温度、反应物的量都会影响反应速率、反应现象和生成物等。
【答案】(1)碳在氧气中充分燃烧和不充分燃烧
(2)硫在空气和氧气中燃烧
(3)过氧化氢溶液在常温和加热的条件下分解速率不同

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
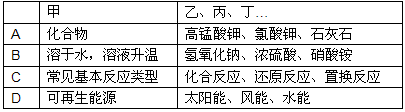
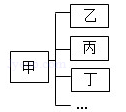
 7、经过一年的化学学习,某同学对所学知识进行归纳,如图所示,则下列归纳的对应关系中,正确的组是( ) 7、经过一年的化学学习,某同学对所学知识进行归纳,如图所示,则下列归纳的对应关系中,正确的组是( )
|
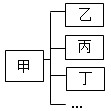 经过一年的化学学习,某同学对所学知识进行归纳,如图所示,则下列归纳的对应关系中,正确的组是
经过一年的化学学习,某同学对所学知识进行归纳,如图所示,则下列归纳的对应关系中,正确的组是
| 甲 | 乙、丙、丁… | |
| A | 化合物 | 高锰酸钾、氯酸钾、石灰石 |
| B | 溶于水,溶液升温 | 氢氧化钠、浓硫酸、硝酸铵 |
| C | 常见基本反应类型 | 化合反应、还原反应、置换反应 |
| D | 可再生能源 | 太阳能、风能、水能 |
- A.A
- B.B
- C.C
- D.D
(2011?包河区一模)经过一年的化学学习,某同学对所学知识进行归纳,如图所示,则下列归纳的对应关系中,正确的组是( )

| 甲 | 乙、丙、丁… | |
| A | 化合物 | 高锰酸钾、氯酸钾、石灰石 |
| B | 溶于水,溶液升温 | 氢氧化钠、浓硫酸、硝酸铵 |
| C | 常见基本反应类型 | 化合反应、还原反应、置换反应 |
| D | 可再生能源 | 太阳能、风能、水能 |

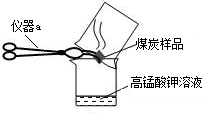
 ”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式:
”.然而化学方程式中最后一种物质的化学式印刷不清楚,根据上下文了解到该物质是一种酸,请根据已学知识推测其化学式: