题目内容
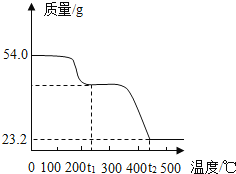
【题目】已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4![]() Fe3O4+4CO↑+2CO2↑.
Fe3O4+4CO↑+2CO2↑.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).
【答案】 (1)43.2g;(2)10.8g;(3)31.1%
【解析】
试题分析:(1)设,草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量为x,
3FeC2O4![]() Fe3O4+4CO↑+2CO2↑
Fe3O4+4CO↑+2CO2↑
432 232
x 23.2g
![]()
x=43.2g
(2)该草酸亚铁晶体中结晶水的质量:54.0g﹣43.2g=10.8g;
(3)四氧化三铁中铁元素的质量:23.2g×![]() =16.8g
=16.8g
该草酸亚铁晶体中铁元素的质量分数:![]() =31.1%;
=31.1%;
答:(1)草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量是43.2g;
(2)该草酸亚铁晶体中结晶水的质量是10.8g;
(3)该草酸亚铁晶体中铁元素的质量分数是31.1%.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
