题目内容
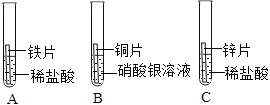
【题目】向CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,生成沉淀的质量变化与加入Na2CO3溶液质量关系如图所示;请回答问题:
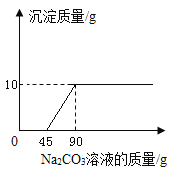
(1)生成沉淀质量为____g;
(2)所用Na2CO3溶液的溶质质量分数为____。(计算结果保留一位小数)
【答案】10g 23.6%.
【解析】
氯化钙和碳酸钠反应生成碳酸钙和氯化钠,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳。
(1) 向CaCl2和HCl的混合溶液中逐滴加入Na2CO3溶液,盐酸先和碳酸钠反应,然后氯化钙和碳酸钠反应生成碳酸钙和氯化钠,由图可知生成沉淀质量为10g。
(2)设所用Na2CO3溶液的溶质质量分数为x
由图可知,氯化钙和碳酸钠完全反应消耗的碳酸钠的质量为![]()
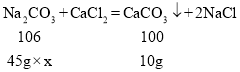
![]()
![]()
答:所用Na2CO3溶液的溶质质量分数为23.6%。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】安琪同学为探究铁制品锈蚀的条件,进行如下实验:
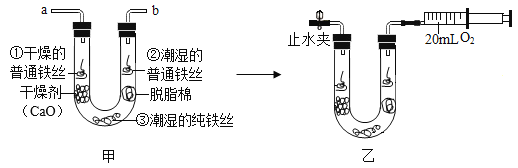
步骤1:利用图甲所示装置,将干燥的O2从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满O2后,在导管b处连接一活塞推至底部的注射器收集20mLO2后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形管内的铁丝其现象如下表所示。
观察对象 | 现 象 |
①干燥的普通铁丝 | 无明显变化 |
②潮湿的普通铁丝 | ___________ |
③潮湿的纯铁丝 | 无明显变化 |
(1)步骤1中,检查U形管内是否已充满O2的方法是____________。
(2)铁制品锈蚀的条件之一是需要O2,在此实验中能支持此条件的证据是_____。
(3)通过对比实验现象,此实验还可得出铁制品锈蚀的条件是_________和__________。
(4)雨后郊外的路比较泥泞,如果你的交通工具是自行车,你回来进行清洗后,采取的防锈措施是: _______(填字母)
A.立即晾晒干 B.涂油漆 C.链条传动部件涂上油
【题目】课外活动小组为测定某未知稀硫酸的质量分数,进行了下面实验:
①取10g稀硫酸于烧杯中,逐滴滴加BaCl2溶液,至不再产生白色沉淀止,经过滤、洗涤,干燥后,称得沉淀物的质量为4.71g
②为保障测定结果的精确性,按实验①操作又连续进行了四次相同的实验。几次实验所得数据见下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
固体质量/g | 4.71 | 4.63 | 4.64 | 4.66 | 4.66 |
分析实验与表中数据后,回答:
(1)第一次实验测得数据明显偏高,可能的原因是______;
(2)五次测定结果的平均值是______;
(3)请利用(2)中数据计算:未知稀硫酸的质量分数是______。(不要求计算过程,计算结果精确到0.01)
【题目】煅烧石灰石(主要成分 CaCO3)生成生石灰(CaO)和二氧化碳。为了测定某石灰石中碳酸钙(CaCO3)的含量,现称取 24.0g 石灰石样品,进行四次高温煅烧、冷却,称量剩余固体的质量 (杂质不参加反应),记录实验数据如下:
操作 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 21.6g | 19.2g | 15.2g | 15.2g |
试计算:
(1)完全反应后生成二氧化碳的质量为_____;
(2)求该石灰石样品中碳酸钙的质量_____。