题目内容
家里蒸馒头用的纯碱中含有少量的氯化钠,课外探究小组的同学欲测定纯碱中碳酸钠的含量.他们取该纯碱样品11.0g,全部溶解在100.0g水中,再加入氯化钙溶液141.0g,恰好完全反应.过滤干燥后,称得沉淀质量为10.0g.请计算:(1)纯碱样品中碳酸钠的质量;
(2)反应后所得滤液中溶质的质量分数.
【答案】分析:根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钙发生反应,碳酸钠与氯化钙生成碳酸钙沉淀和氯化钠,根据生成沉淀碳酸钙的质量可计算样品中所含碳酸钠的质量;
恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成,反应后溶液的质量可使用质量守恒定律的方法进行解决,以简化分析.
解答:解:设恰好完全反应时参加反应的碳酸钠的质量为x,反应生成的氯化钠质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10.0g y
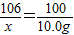 x=10.6g
x=10.6g
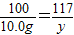 y=11.7g
y=11.7g
反应后所得滤液中溶质的质量分数=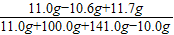 ×100%=5%
×100%=5%
答:(1)纯碱样品中碳酸钠的质量为10.6g;(2)反应后所得滤液中溶质的质量分数为5%.
点评:在计算反应后所得溶液的溶质质量分数时,原混合固体中的氯化钠不要忘记算入溶质的质量,此题在这个地方设置一个小陷阱.
恰好完全反应后所得溶液为氯化钠溶液,此时溶液中的溶质氯化钠由原固体中的氯化钠和反应后生成的氯化钠两部分构成,反应后溶液的质量可使用质量守恒定律的方法进行解决,以简化分析.
解答:解:设恰好完全反应时参加反应的碳酸钠的质量为x,反应生成的氯化钠质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 10.0g y
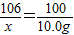 x=10.6g
x=10.6g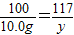 y=11.7g
y=11.7g反应后所得滤液中溶质的质量分数=
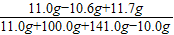 ×100%=5%
×100%=5%答:(1)纯碱样品中碳酸钠的质量为10.6g;(2)反应后所得滤液中溶质的质量分数为5%.
点评:在计算反应后所得溶液的溶质质量分数时,原混合固体中的氯化钠不要忘记算入溶质的质量,此题在这个地方设置一个小陷阱.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目