题目内容
【题目】某学校化学兴趣小组用NaCl固体(含有的杂质CaO)来配制一定质量分数的NaCl溶液,实验的流程图如下: 
请回答:
(1)写出适量HCl加入到溶液B中所发生反应的化学方程式为 .
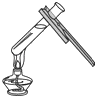
(2)操作2的名称是 , 在溶液A中加入过量碳酸钠的目的是 .
(3)若要配制100g质量分数为5.5%的氯化钠溶液,除了用到天平、烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 , 其作用是 .
(4)如果配制后溶液溶质的质量分数低于5.5%,你认为可能的原因是 . (任写一个)
【答案】
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)过滤;充分除尽溶液中的氢氧化钙
(3)玻璃棒;搅拌加快食盐溶解速率
(4)用量筒量取水时错误,如取水时仰视读数、烧杯中有水
【解析】(1)Na2CO3会与盐酸反应生成氯化钠、水和二氧化碳,故反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;(2)把碳酸钠加入A溶液中后,生成碳酸钙沉淀和氯化钠溶液,要把碳酸钙除去,可以用过滤的方法,所加碳酸钠一定要足量,以便把A中的氢氧化钙除完;故答案为:过滤;充分除尽溶液中的氢氧化钙;(3)配制一定质量分数的溶液用到的仪器有:天平、烧杯、量筒、玻璃棒;玻璃棒的作用是搅拌加快食盐溶解速率;故答案为:玻璃棒;搅拌加快食盐溶解速率;(4)称量NaCl的操作错误,如左盘放了纸片,右盘未放纸片;用量筒量取水时错误,如取水时仰视读数、烧杯中有水;氯化钠中混有杂质都可能配制后溶液溶质的质量分数低于5.5%.
故答案为:用量筒量取水时错误,如取水时仰视读数、烧杯中有水.
(1)根据碳酸钠与盐酸反应的原理分析;(2)根据过滤操作的适用范围分析,根据除杂时所加试剂的原则分析;(3)根据玻璃棒的作用分析;(4)根据配制后溶液溶质的质量分数低于5.5%可能是水多了或者是氯化钠少了进行解答.

 英才计划期末调研系列答案
英才计划期末调研系列答案