题目内容
【题目】构建知识网络能帮助我们理解知识间的内在联系,请分析如图知识网络,回答有关问题。(连线表示相互反应)
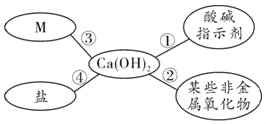
(1)小红将无色酚酞试液滴加到Ca(OH)2溶液中,溶液呈_____色。
(2)氢氧化钙可由生石灰与水反应制得,该反应的化学方程式为_____。
(3)图中M所属的物质类别是_____。
(4)由性质②可知Ca(OH)2溶液暴露在空气中会变质,必须密封保存,其反应的化学方程式为:_____。
(5)为了验证性质④,可选择的物质是_____(填序号)。
A Na2CO3 B HCl C KCl D CuSO4
【答案】红 CaO+H2O==Ca(OH)2 酸 Ca(OH)2+CO2==CaCO3↓+H2O A、D
【解析】
显碱性溶液能使酚酞试液变红色;酸和碱反应生成盐和水,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠、和硫酸铜反应生成氢氧化铜沉淀和硫酸钠。
(1)小红将无色酚酞试液滴加到Ca(OH)2溶液中,溶液呈红色;
(2)氢氧化钙可由生石灰与水反应制得,这是因为氧化钙和水反应生成氢氧化钙,该反应的化学方程式为:CaO+H2O═Ca(OH)2;
(3)图中M所属的物质类别是酸,酸能和碱反应生成盐和水;
(4)氢氧化钙能和空气中的二氧化碳反应生成碳酸钙沉淀和水,其反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O;
(5)为了验证性质④,可选择的物质是碳酸钠、硫酸铜,这是因为氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,和硫酸铜反应生成氢氧化铜沉淀和硫酸钠。

 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
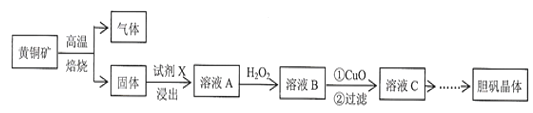
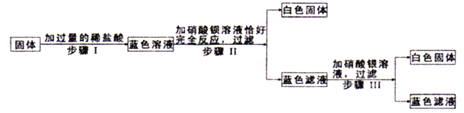
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】室温为25℃时,某小组用无水氯化铜粉末制备氯化铜大晶体,制备过程如下:
步骤I:查阅资料,得到氯化铜溶解度数据如下
温度(℃) | 0 | 20 | 25 | 40 | 50 | 60 | 80 |
溶解度(g) | 69.2 | 74.5 | 76.4 | 81.8 | 85.5 | 89.4 | 98.0 |
步骤Ⅱ:配制少量CuCl2热饱和溶液,冷却结晶,得到晶种。
步骤Ⅲ:把晶种悬挂在新配制的CuCl2热饱和溶液中,室温下静置数天,形成大晶体。
步骤Ⅳ:取出大晶体,处理剩余的溶液(母液)。
根据以上信息,回答下列问题:
(1)用20mL蒸馏水(密度约为1g/mL)配制50℃的氯化铜饱和溶液。
①计算需称取CuCl2的质量是_______g。
②将称取的CuCl2固体和20mL水倒入烧杯中,_______________(填操作名称),直至固体完全溶解。
(2)母液中Cu2+属于重金属离子,随意排放将导致环境污染。下列方法可用于母液处理的是__________。
A.收集母液于敞口容器中,用报纸包住容器口,待水分自然蒸干后保存所得固体
B.向母液中加入适量AgNO3,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
C.向母液中加入适量NaOH,充分反应后过滤,滤渣干燥保存,滤液倒入下水道
(3)若用铁粉置换出母液中的铜,100g母液需要铁粉的质量至少是_____________ g(只列计算式,已知CuCl2的相对分子质量为135)。