题目内容
【题目】小明发现一种胃药,并对其中的成分氢氧化镁性质进行了如下探究。
【提出问题】胃药为什么嚼碎后服用?
【查阅资料】氢氧化镁治疗胃酸过多的化学反应方程式是___________________________。
【设计实验】
实验一:将一片完整的药片放入试管中,加入10 mL 5%的稀盐酸,记录固体消失时间。
实验二:将药品进行________处理后放入试管中,加入10 mL 5%的稀盐酸,记录固体消失时间。
【现象与结论】
(1)实验二比实验一反应快。
(2)要加快化学反应的速率,可以采用________________________的方法。
【知识拓展】探究氢氧化镁的受热分解:
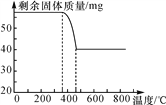
氢氧化镁分解过程中温度与剩余固体的质量关系如图所示,已知氢氧化镁分解可生成两种氧化物。400 ℃时剩余固体的成分是________________,将该剩余固体做治疗胃酸过多的药物是否可行?________(填“可行”或“不可行”)。
【知识应用】氢氧化镁还是一种良好的阻燃剂,能防止火灾。根据以上探究请写出氢氧化镁能做阻燃剂的原因:____________________________________________________________________________(写出一点即可)。
【答案】 Mg(OH)2+2HCl=== MgCl2+2H2O 研磨 增大反应物间的接触面积 氧化镁和氢氧化镁 可行 分解过程吸收大量的热,使可燃物的温度降到着火点以下(生成的氧化镁是一种耐高温材料,也可以隔绝易燃物与氧气的接触)
【解析】(1). 胃酸的主要成分是盐酸,氢氧化镁治疗胃酸过多的化学反应方程式是:Mg(OH)2+2HCl=== MgCl2+2H2O ; (2). 将药品进行研磨处理后放入试管中,增大反应物的接触面积,使反应更充分,更迅速; (3).由图可知,氢氧化镁在400 ℃时没有完全分解,剩余固体的成分是生成的氧化镁和剩余的氢氧化镁;(5). 氧化镁和氢氧化镁都能与盐酸反应生成氯化镁和水,都可以用来治疗胃酸过多; (6). 燃烧是可燃物与氧气充分接触发生的发光、放热的剧烈的氧化反应。燃烧需要同时具备的三个条件:物质有可燃性、温度达可燃物的着火点、与氧气充分接触;灭火时只需要破坏一个条件即可。氢氧化镁是一种良好的阻燃剂,能防止火灾的原因是:分解过程吸收大量的热,使可燃物的温度降到着火点以下,同时生成的氧化镁是一种耐高温材料,也可以隔绝易燃物与氧气的接触而灭火。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案

