题目内容
解释下列问题(用化学方程式表示):(1)为什么在一些烟花和照明弹中含有镁粉?
(2)为什么不用铝制容器盛放硫酸铜溶液?
(3)为什么用盐酸可以除去铁锈(主要成分是Fe2O3 )?
分析:(1)根据镁燃烧会发出耀眼的白光进行分析;
(2)根据金属活动性顺序进行分析;
(3)根据酸会与金属氧化物反应进行分析.
(2)根据金属活动性顺序进行分析;
(3)根据酸会与金属氧化物反应进行分析.
解答:解:(1)镁和氧气在点燃的条件下生成氧化镁,发出耀眼的白光,故答案为:2Mg+O2
2MgO;
(2)铝和硫酸铜反应会生成硫酸铝和铜,故答案为:2Al+3CuSO4=Al2(SO4)3+3Cu;
(3)盐酸和氧化铁反应生成氯化铁和水,故答案为:Fe2O3+6HCl=2FeCl3+3H2O.
| ||
(2)铝和硫酸铜反应会生成硫酸铝和铜,故答案为:2Al+3CuSO4=Al2(SO4)3+3Cu;
(3)盐酸和氧化铁反应生成氯化铁和水,故答案为:Fe2O3+6HCl=2FeCl3+3H2O.
点评:在解此类方程式的书写题时,首先确定反应原理,然后再依据原理找出反应物、生成物和反应条件,根据方程式的书写规则书写方程式.

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
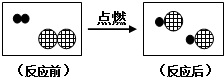 解释下列问题(用化学方程式表示):
解释下列问题(用化学方程式表示): ”表示H原子,用“
”表示H原子,用“ ”表示Cl原子,则如图中反应后容器内的物质属于
”表示Cl原子,则如图中反应后容器内的物质属于