题目内容
【题目】近年来,世界各国都遭遇各种极端天气,引起人们普遍的关注,其原因可能是________。大同是国家能源基地,盛产煤炭,为了可持续发展,现在正在逐步实现战略转型,取得了一定的成效。
(1)最理想清洁的能源是________。燃煤发电时,将煤块粉碎成煤粉,其目的是________。
(2)“绿色化学”的特点之一是“零排放”。一定条件下,二氧化碳和氢气可以按照不同比例反应,只生成一种产物甲酸(![]() ),写出这个反应的化学方程式________。
),写出这个反应的化学方程式________。
(3)大同市2019年能源革命的重大突破之一是低碳工程。如图是某大型成就展中的“碳足迹计算器”模型,“碳足迹计算器”能帮助公众计算出居家、出游及办公时的二氧化碳排放量。倡导“低碳”生活,应从生活中的点滴做起。下列做法不符合“低碳”理念的是________。

A外出随手关灯 B双面使用纸张
C骑自行车出行 D丢弃未喝完的矿泉水瓶
【答案】生态遭到破坏(或温室效应的加剧、二氧化碳的大量、排放森林或植被被破坏)等(合理即可) 氢气 增大与氧气的接触面积,燃烧充分  D
D
【解析】
近年来,世界各国都遭遇各种极端天气,引起人们普遍的关注,其原因可能是生态遭到破坏(或温室效应的加剧、二氧化碳的大量、排放森林或植被被破坏)等(合理即可);
(1)氢气的资源丰富、热值高、燃烧产物只有水,不会对环境造成任何污染,所以是最理想的能源,将煤块粉碎成煤粉,能够增大煤与氧气的接触面积,燃烧充分;
(2)一定条件下,二氧化碳和氢气可以按照不同比例反应,只生成一种产物甲酸(CH2O2),反应的化学方程式为: ;
;
(3)A 外出随手关灯可以节约电能,符合“低碳”要求;
B 双面使用纸张可以节约能量,减少树木砍伐,符合“低碳”要求;
C 骑自行车出行可以节约化石燃料,符合“低碳”要求;
D 丢弃未喝完的矿泉水瓶既浪费资源,又污染环境,不符合“低碳”要求。故选D。

 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
(查阅资料)
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(![]() 和
和![]() )及不溶性杂质,生产过程中需先将粗盐精制。
)及不溶性杂质,生产过程中需先将粗盐精制。
③生产原理:![]() 。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是:![]() 。
。
⑤部分生产流程如图所示:
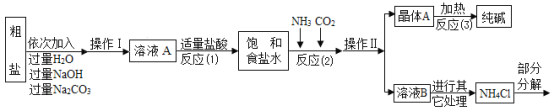
(问题讨论)
(1)①写出加入NaOH溶液所发生反应的化学方程式________。
②反应(1)中加入适量盐酸的目的是________。
(2)上述生产流程中可循环使用的物质是________(填字母)。
A![]() B NaOH C HCl D
B NaOH C HCl D![]()
(组成探究一)
(3)①晶体A受热分解的化学方程式为________。
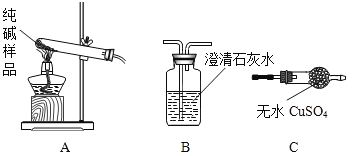
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(装置从下图中选择)
选择的装置 | 实验现象 | 实验结论 |
________(填字母) | ________ | 样品不含晶体A |
(组成探究二)
(4)取纯碱样品加水溶解,向该溶液中加入过量稀![]() ,再滴加
,再滴加![]() 溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
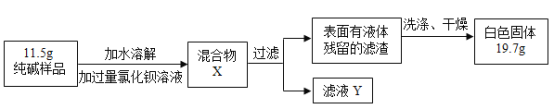
①氯化钡溶液过量的目的是________。判断氯化钡已过量的方法是________。
②判断滤渣是否洗净的方法是:取最后一次洗涤液少许于试管中,滴加________,若无沉淀产生,则已洗净。
③根据实验数据,计算样品中碳酸钠的质量分数为________(列出计算过程,保留一位小数)。
【题目】某化学学习小组在完成“利用氯化钡溶液鉴别氯化钠和碳酸钠”的实验后,对废液缸中溶液的溶质成分进行了探究。请完成以下探究过程。
(提出问题)_____________?
(作出猜想)Ⅰ.溶质仅为氯化钠;Ⅱ溶质为氯化钡和氯化钠;Ⅲ._______________。
(设计方案)
实验操作 | 现象 | 结论 |
取少量废液缸中上层清液,向其中加入一定量的______________溶液。(填化学式,限填一种) | 无明显现象 | 猜想Ⅰ正确 |
______ | 猜想Ⅱ正确 | |
有气泡产生 | 猜想Ⅲ正确 |
(交流反思)学习小组经过讨论认为,含有可溶性钡盐的废液可以用碳酸钠溶液进行无害化处理。请写出硝酸钡与碳酸钠反应的化学方程式___________________。
若是人误吃了可溶性钡盐,不能服用碳酸钠溶液解毒而是服用硫酸钠溶液,理由是_______。
【题目】2019年山西省实验考试新增了《用盐酸除铁锈》的实验试题,同学们在练习实验操作时,发现实验题中的要求有“先将生锈铁钉放在试管中,加入稀盐酸,加热试管”。其中“加热”的目的是________,之后观察到铁锈消失,溶液变为黄色。同学们将实验后的黄色废液倒入废液缸,化学研究小组同学对该废液的成分产生了兴趣并进行探究。
(查阅资料)
①![]()
②![]() 的检验:加入铁氰化钾(化学式为
的检验:加入铁氰化钾(化学式为![]() )溶液,生成铁氰化亚铁蓝色沉淀。
)溶液,生成铁氰化亚铁蓝色沉淀。
(提出问题)
废液中含有哪些离子?
(猜想假设)
同学们经过分析认为,废液中一定有的离子是![]() 、
、![]() ,对于可能存在的其中一种离子,兴趣小组的同学们首先进行了如下实验:
,对于可能存在的其中一种离子,兴趣小组的同学们首先进行了如下实验:
(实验操作一)
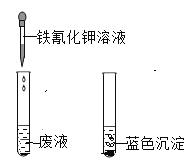
结论:________一定存在。
接下来同学们对这种离子的来源展开了讨论,绝大多数同学认为是Fe和![]() 发生反应生成,也有同学对此提出质疑,他们质疑的理由是________(用化学方程式表示)。
发生反应生成,也有同学对此提出质疑,他们质疑的理由是________(用化学方程式表示)。
(实验操作二)
经过分析,同学们认为还有另一种离子也可能存在,为了证明这种离子是否存在,请你帮助他们一起进行实验:
实验步骤 | 实验现象 | 结论 | |
方案一 | 取少量废液于试管中,加入紫色石蕊溶液 | ______________________ | 可能存在的离子一定存在 |
方案二 | ___________________ | ______________________ |
通过以上探究活动得知,这种黄色废液中一定含有的物质是________(写化学式)。
(反思评价)
实验后的废液直接倾倒,会造成土壤、水源污染,要做到绿色排放,需在废液中加入适量的________。
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取5g混合物,放入一干净的烧杯中,然后取50g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
生成气体的总质量/g | 0.05 | m | 0.15 | 0.18 | n |
(l)上表中m=_____、n=_____.
(2)请计算所用稀硫酸的溶质质量分数(结果保留一位小数).____
(3)固体混合物中,硫酸镁的质量分数为_____.