题目内容
某样品为铜和氧化铜的混合物,甲、乙、丙三位同学,用同一样品20g分别进行实验,测定试验数据如下表
(1)样品中氧化铜的质量为 ;
(2)计算硫酸溶液中的溶质质量分数.
| 甲 | 乙 | 丙 | |
| 所取固体样品的质量/g | 20 | 20 | 20 |
| 加入硫酸溶液质量/g | 50 | 100 | 150 |
| 反应剩余固体质量/g | 16 | 12 | 12 |
(2)计算硫酸溶液中的溶质质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:完全反应后剩余固体是铜,根据铜的质量可以计算氧化铜的质量;
根据氧化铜的质量可以计算硫酸的质量,进一步可以计算稀硫酸的质量分数.
根据氧化铜的质量可以计算硫酸的质量,进一步可以计算稀硫酸的质量分数.
解答:解:(1)氧化铜的质量为:20g-12g=8g,
故填:8g.
(2)设50g硫酸溶液中溶质的质量为x,
H2SO4+CuO=CuSO4+H2O,
98 80
x 4g
=
,
x=4.9g,
硫酸溶液中的溶质质量分数为:
×100%=9.8%,
答:稀硫酸的质量分数是9.8%.
故填:8g.
(2)设50g硫酸溶液中溶质的质量为x,
H2SO4+CuO=CuSO4+H2O,
98 80
x 4g
| 98 |
| x |
| 80 |
| 4g |
x=4.9g,
硫酸溶液中的溶质质量分数为:
| 4.9g |
| 50g |
答:稀硫酸的质量分数是9.8%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
下列化学实验操作正确的是( )
A、 称量氢氧化钠固体 |
B、 过滤 |
C、 稀释浓硫酸 |
D、 检查装置气密性 |
安徽省科技活动周紧紧围绕“携手建设创新型安徽”的这一主题,突出“科技与文化融合、与生活同行”这一主线,并提出了“节约能源资源、保护生态环境、保障安全建设”的理念,下列说法不符合这一理念的是( )
| A、社区宣传节水节电小窍门 |
| B、加大开采煤矿力度 |
| C、合理设置空调温度 |
| D、拒绝使用一次性筷子和餐巾纸 |


 某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应,也不溶于水的固体杂质)于烧杯中,加入9.8%的稀硫酸100g,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应,也不溶于水的固体杂质)于烧杯中,加入9.8%的稀硫酸100g,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
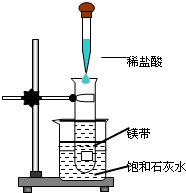 如图所示,把试管放入盛有25°C时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25°C时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题: