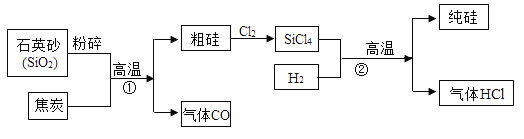
题目内容
【题目】把A、B、C、D四种纯净物放在一密闭容器中反应,反应前后各物质的质量如下表:
| A | B | C | D |
反应前质量/g | 28 | 6 | 2 | 4 |
反应后质量/g | 2 | 6 | 12 | 未知 |
(1)该反应生成物是______,B可能是___________,反应后D的质量是_______g
(2)该反应的属于哪种基本反应类型___________ 。
(3)请写出一个与该反应类型相同的一个化学方程式___________。
(4)物质A是__________(填“单质 ”或“ 化合物”)
【答案】CD 可能是催化剂,可能是不参加反应的杂质 20g 分解反应 2H2O2![]() 2H2O+O2↑(合理即可) 化合物
2H2O+O2↑(合理即可) 化合物
【解析】
(1)根据质量守恒定律,未知=28+6+4+2-2-6-12=20,A的质量减少,是反应物;C、D质量增加,是生成物;B质量不变,可能是催化剂,可能是不参加反应的杂质。反应后D的质量为20g。
(2)由上分析可知,该反应是由一种物质反应生成两种物质,故是分解反应。
(3)该反应是由一种物质反应生成两种物质,是分解反应。过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,反应类型相同,反应的方程式为:2H2O2![]() 2H2O+O2↑(合理即可)。
2H2O+O2↑(合理即可)。
(4)物质A是分解反应中的反应物,故A一定是化合物。

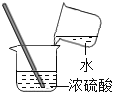
【题目】以下是某研究小组探究影响化学反应速率快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | / | 125 | 148 |
④ | 30 | 12 | 90 | / | 125 | 82 |
(1)通过实验①和②对比可知,化学反应快慢与_____有关;
(2)通过对比实验_____和_____可知(填序号),化学反应快慢与温度的关系是_____。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是_____。
(4)写出该反应的化学方程式_____。