题目内容
【题目】室温时,将氢氧化钠溶液与盐酸用滴加方式反应时,溶液的pH随滴入溶液体积变化如图所示.下列有关说法不正确的是( )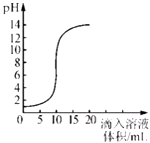
A.该图象表示的是将氢氧化钠溶液滴入盐酸中
B.氢氧化钠溶液和盐酸恰好完全反应时.溶液的pH等于7
C.滴入溶液体积为15mL时,再加几滴紫色石蕊试液溶液呈蓝色
D.当滴入溶液的体积为5mL时,所得溶液中的溶质只有NaCl
【答案】D
【解析】A.根据图象,在反应未进行时,溶液的pH=1,为强酸性溶液,所以该曲线反应是将氢氧化钠溶液滴入盐酸中,故说法正确,A不符合题意;
B.氢氧化钠溶液和盐酸恰好反应时,溶液显中性,溶液pH=7,故说法正确,B不符合题意;
C.滴入溶液体积为15mL时,氢氧化钠过量,溶液显碱性,能使紫色的石蕊试液变蓝色,故说法正确,C不符合题意;
D.当滴入溶液的体积为5mL时,溶液的pH小于7,盐酸还有剩余,此刻溶液中的溶质是HCl、NaCl,故说法错误,D符合题意.
故答案为:D.
A.当溶液的pH<7时,溶液显酸性,当溶液的pH>7时,溶液显碱性,当溶液的pH=7时,溶液显中性,据此判断即可;
B.氢氧化钠溶液和盐酸恰好反应时,溶液显中性,溶液pH=7,据此判断即可;
C.根据溶液的酸碱性以及能使紫色石蕊试液的变色情况来分析;
D.根据盐酸和氢氧化钠的反应原理以及图象数据来分析判断即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目