题目内容
【题目】有等质量的镁和锌,前者放入质量分数为10%的稀盐酸中,后者放入质量分数为10%的稀硫酸中,产生氢气的质量随时间变化曲线如图所示。下列说法正确的是( )
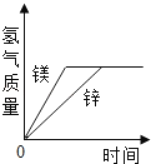
A. 锌一定没有剩余
B. 消耗的稀盐酸和稀硫酸质量之比为73:98
C. 最终产生氢气的质量相等
D. 消耗镁的质量与消耗锌的质量之比为1:1
【答案】BC
【解析】
A、等质量的不同金属得到的氢气一样多,说明参与反应的金属的质量一定不一样多,因此至少有一种金属剩余,由M~H2可知,相对原子质量小的金属有剩余,则镁有剩余,而锌没有剩余。故A错误;
B、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,则2HCl~2H~H2SO4,稀盐酸和稀硫酸质量之比为36.5×2:98=73:98,故B正确;
C、根据图象可以得到,最终产生的氢气的质量相等,故C正确;
D、由于锌的相对原子质量大,因此得到相同质量的氢气,参加反应的金属锌的质量要大一些,则消耗的镁与锌的质量
之比不等于1:1,故D错误;
故选:BC。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案【题目】通过下列实验操作和现象能得出相对应结论的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是可燃物燃烧的条件之一 |
B | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有无色液滴产生 | 被点燃的气体一定是H2 |
C | 某溶液中加入BaCl2溶液和稀硝酸 | 有白色沉淀产生 | 溶液中一定含有硫酸根离子 |
D | 向收集满CO2的软塑料瓶中加入约 | 塑料瓶变瘪 | CO2能与食盐反应 |
A. AB. BC. CD. D
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
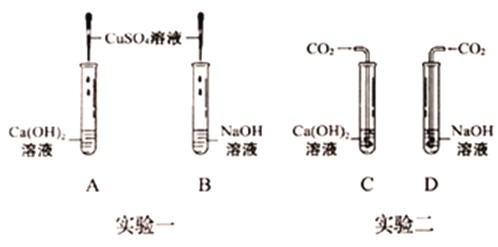
(1)实验一中,B试管中发生反应的化学方程式为_____。
A、B两支试管中共同的实验现象是_____。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是_____(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
(提出猜想)猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 | _____ | 猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
(反思与评价)I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是_____。
若要验证猜想2成立,需将Ca(OH)2溶液换成_____溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是_____(用文字叙述)
【题目】某实验学校初三兴趣小组利用如下装置(部分固定装置已略去)。制备氮化钙,并探究其化学式
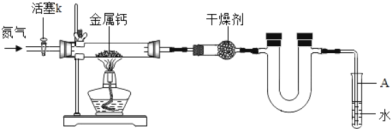
(1)反应过程中末端导管必须插入试管A的水中,目的是_____。
(2)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后,_____;④拆除装置,取出产物。
(3)数据记录如下:
空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
114.8 | 120.8 | 122.2 |
①计算得到化学式(实验式)CaxN2,其中x=_____。
②若通入的N2中混有少量O2,如上计算得到的x的值_____ (填写“偏大”、“偏小”、“不变”),判断依据是_____。