题目内容
【题目】钠元素是化学研究的重要内容。已知:过氧化钠(固体,化学式为Na2O2)与水反应生成氢氧化钠和氧气;过氧化钠与二氧化碳反应生成碳酸钠和氧气。上述反应涉及的三种含钠化合物在社会生产发展中起着重要的作用。
(1)钠的原子结构示意图为 。钠元素位于元素周期表第三周期的 (填 “开头”、“中间”、“靠近尾部”或“结尾”)处。
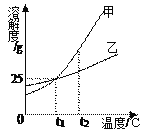
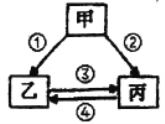
(2)甲、乙、丙分别为上述三种含钠化合物的一种,它们之间的转化关系如图所示。其中反应①的发生需要二氧化碳,且丙中氧的质量分数为40%。写出以下反应的化学方程式:
反应②为 ;反应③为 。
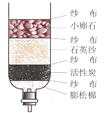
(3)以下是化学兴趣小组利用如下图所示实验装置进行制取氧气的探究活动。
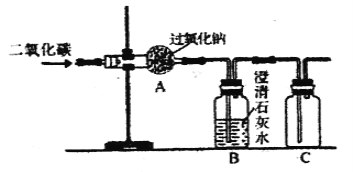
①若CO2未被Na2O2完全吸收,装置B中的实验现象为 。
②取上述实验后装置A中固体,加入足量水,有气泡产生,并得到无色溶液。同学们分析后得出溶液中成分。如何检验所得溶液中含有的溶质?(简要写出实验步骤与现象)
(4)若将21.2g久置于空气中的氢氧化钠固体样品加入足量的稀硫酸,产生CO2气体4.4g。请计算样品中碳酸钠的质量是多少?
【答案】(1)![]() ;开头;(2)2Na2O2+ 2H2O=4NaOH+O2↑;Ca(OH)2+ Na2CO3=CaCO3↓+ 2NaOH;(其他合理答案也可)(3)①澄清石灰水变浑浊;② 取样,加入足量CaCl2(或BaCl2等)溶液,静置,然后向上层清液中滴加无色酚酞溶液;实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠。(4)碳酸钠的质量为10.6g
;开头;(2)2Na2O2+ 2H2O=4NaOH+O2↑;Ca(OH)2+ Na2CO3=CaCO3↓+ 2NaOH;(其他合理答案也可)(3)①澄清石灰水变浑浊;② 取样,加入足量CaCl2(或BaCl2等)溶液,静置,然后向上层清液中滴加无色酚酞溶液;实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠。(4)碳酸钠的质量为10.6g
【解析】过氧化钠(固体,化学式为Na2O2)与水反应生成氢氧化钠和氧气;过氧化钠与二氧化碳反应生成碳酸钠和氧气。(1)钠的原子结构示意图为![]() 。钠元素位于元素周期表第三周期的开头处。(2)甲、乙、丙分别为上述三种含钠化合物的一种,它们之间的转化关系如图所示。其中反应①的发生需要二氧化碳,且丙中氧的质量分数为40%。以下反应的化学方程式:反应②为2Na2O2+ 2H2O=4NaOH+O2↑;反应③为Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH。(3)实验装置进行制取氧气的探究活动。①若CO2未被Na2O2完全吸收,装置B中的实验现象为澄清石灰水变浑浊。②取上述实验后装置A中固体,加入足量水,有气泡产生,并得到无色溶液。检验所得溶液中含有的溶质是取样,加入足量CaCl2(或BaCl2等)溶液,静置,然后向上层清液中滴加无色酚酞溶液;实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠。(4)Na2CO3→CO2 ,
。钠元素位于元素周期表第三周期的开头处。(2)甲、乙、丙分别为上述三种含钠化合物的一种,它们之间的转化关系如图所示。其中反应①的发生需要二氧化碳,且丙中氧的质量分数为40%。以下反应的化学方程式:反应②为2Na2O2+ 2H2O=4NaOH+O2↑;反应③为Ca(OH)2+ Na2CO3=CaCO3↓+2NaOH。(3)实验装置进行制取氧气的探究活动。①若CO2未被Na2O2完全吸收,装置B中的实验现象为澄清石灰水变浑浊。②取上述实验后装置A中固体,加入足量水,有气泡产生,并得到无色溶液。检验所得溶液中含有的溶质是取样,加入足量CaCl2(或BaCl2等)溶液,静置,然后向上层清液中滴加无色酚酞溶液;实验现象分别为先产生白色沉淀,然后是溶液变为红色,分别检验了溶液中的碳酸钠和氢氧化钠。(4)Na2CO3→CO2 ,![]() =
=![]() ,x=10.6g, 品中碳酸钠的质量是10.6g
,x=10.6g, 品中碳酸钠的质量是10.6g
点睛∶本题主要考查钠及其化合物的性质,根据化学方程式进行计算。

【题目】土壤的酸碱度会影响植物的生长。下列植物在微酸性土壤中,不适宜种植的是
植物 | 花生 | 苹果 | 西瓜 | 沙枣 |
适宜的pH范围 | 5.0~6.0 | 5.0~6.5 | 6.0~7.0 | 8.0~8.7 |
A. 花生 B. 苹果 C. 西瓜 D. 沙枣