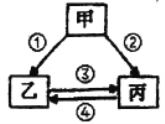
题目内容
【题目】为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:
(1)该黄铜样品中锌的质量。
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
【答案】黄铜中锌的质量6.5g 反应后所得溶液中溶质质量分数为15.1%
【解析】
试题分析:(1)根据题意,向黄铜中加入稀硫酸,黄铜中的锌会与硫酸发生反应,而铜不反应,故根据参加反应的硫酸的质量,和反应的化学方程式,即可求出锌的质量。
100g9.8%的稀硫酸中含纯硫酸的质量=100g×9.8%=9.8g
解,设黄铜样品中锌的质量为x
Zn + H2SO4 = ZnSO4 + H2↑
65 98
x 9.8g
65:x=98:9.8g
解得,x=6.5g
答:黄铜样品中锌的质量为 6.5g。
(2)根据题意,反应后的溶液为硫酸锌溶液,即溶质是硫酸锌,同样可根据硫酸的质量求出硫酸锌的质量;而反应后所得溶液的质量=锌的质量+稀硫酸的质量-氢气的质量,最后根据溶液的溶质质量分数=![]() ×100%计算即可。
×100%计算即可。
解,设充分反应后生成硫酸锌的质量为y,生成氢气的质量为z
Zn + H2SO4 = ZnSO4 + H2↑
98 161 2
9.8g y z
98:161=9.8g:y
解得,y=16.1g
98:2=9.8g:z
解得,z=0.2g
则反应后所得溶液中溶质的质量分数=![]() ×100%=15.1%
×100%=15.1%
答:反应后所得溶液中溶质的质量分数为15.1%。

【题目】某校化学兴趣小组的同学 设计了如图所示的简易灭火器,他们对反应后废液的成分展开了探究:
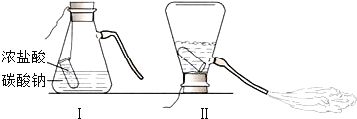
提出问题:反应后的废液中含有哪些成分?
猜想与实验:上图反应的化学方程式为 _______________________________,
由此推出废液中一定含有氯化钠溶液,可能含有碳酸钠溶液或盐酸.
实验一:确定该废液中是否含有盐酸
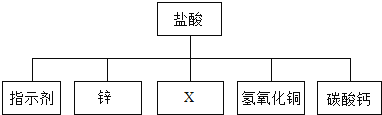
(1)选择试剂:根据盐酸的化学性质(即酸的通性),同学们选择了下图所示五种不同类别的物质,其中,X可以是 __________(填一种具体物质化学式).
(2)实验验证:某同学取少量废液于试管中,向其中加入少量锌粒,观察到 ______,确定废液中一定不含有盐酸.
实验二:确定废液中是否还有碳酸钠
实验操作 | 现象 | 结论 |
取少量废液于试管中,滴加少 量的氢氧化钙溶液 | ______ | 废液中含有碳酸钠。 有关化学方程式:_______。 |
实验三:处理废液,回收氯化钠
欲从废液中得到纯净的氯化钠,向废液中加入过量的__________,再经过蒸发结晶即可得到纯净的氯化钠晶体。