题目内容
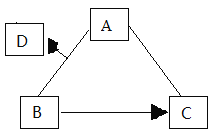
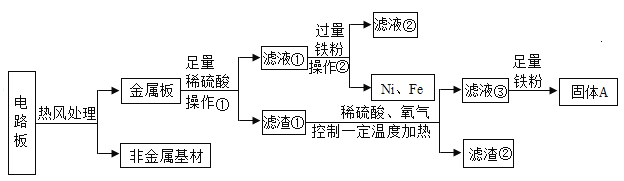
【题目】废旧电子产品的回收再利用有利于节约金属资源和减少污染。某种手机电路板中含有Fe、Cu、Au、Ag、Ni(镍,银白色金属)等金属,下图是某工厂回收部分金属的流程图。
已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O
2CuSO4+2H2O
(1)操作①的名称是________________。
(2)滤液①中加入过量铁粉的目的是_____________。
(3)写出滤液①中加入过量铁粉后其中一个反应化学方程式________________。
(4)Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是________________。
【答案】过滤 置换出滤液①中的所有的镍 ![]() 或
或![]() Ni>Cu>Ag
Ni>Cu>Ag
【解析】
(1)由流程图可知操作①实现了滤液和滤渣的分离,即分离了固体和液体,故操作①的名称是过滤。
(2)滤液①中加入过量铁粉再经过操作②分离出了单质铁和镍,说明金属板加入稀硫酸反应过程中铁、镍都参与反应了,加入过量铁粉又会生成镍,利用的原理是铁置换出滤液①中的所有的镍。
(3) 由流程图可知金属板与足量稀硫酸反应将铁、镍反应,硫酸有剩余,滤液①中含有硫酸,加入铁粉铁与硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为![]() ;根据(2)的分析,滤液①中加入过量铁粉后,镍被置换出来,则有反应铁与硫酸镍反应生成镍单质和硫酸亚铁,反应的化学方程式为
;根据(2)的分析,滤液①中加入过量铁粉后,镍被置换出来,则有反应铁与硫酸镍反应生成镍单质和硫酸亚铁,反应的化学方程式为![]() 。
。
(4)由流程图可知镍能与稀硫酸反应,说明镍的金属活动性应该位于金属活动性顺序表中氢之前,已知Cu的金属活动性大于Ag,且都位于金属活动性顺序表氢之后,则Cu、Ag、Ni在溶液中的活动性由强到弱的顺序依次是Ni>Cu>Ag。

 名校课堂系列答案
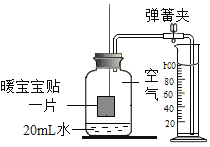
名校课堂系列答案【题目】为验证氢氧化钠的化学性质某兴趣小组同学做了如图所示实验。请根据实验回答问题
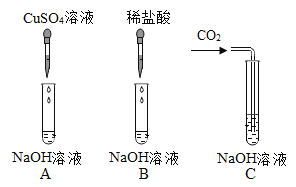
(1)A试管中观察到的实验现象是_____。
(2)甲同学观察到B试管中无明显现象,然后向B试管中继续滴加1~2滴无色酚酞溶液,振荡后溶液仍为无色。此现象_____(填“能”或“不能”)证明氢氧化钠溶液和稀盐酸发生了反应。
(3)为了验证C试管中有碳酸钠生成,乙同学设计的实验方案如表所示,请你帮助填写完整。
(查阅资料)碳酸钠溶液显碱性
方案 | 实验步骤 | 实验现象 | 反应的化学方程式 |
一 | ①取少量反应后溶液于另一支试管中 ②加入过量的稀盐酸 | _____ | _____ |
二 | ①_____ ②_____ | _____ | _____ |