题目内容
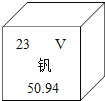
【题目】将3.6 gCaCO3高温煅烧一段时间后冷却,测得固体剩余物中钙元素的质量分数为57.6%,则固体剩余物中氧化钙的质量是
A.1.44g B.2.5g C.1.4g D.2.016g
【答案】C
【解析】
试题分析:3.6克碳酸钙中含有的钙元素的质量=3.6克×40/100=1.44克,因为剩余固体中钙元素的质量分数为57.6%,所以剩余固体的质量=1.44克/57.6%=2.5克,所以生成二氧化碳的质量为3.6克-2.5克=1..1克,设生成二氧化碳的质量为1.1克,生成氧化钙的质量为X,
CaCO3 高温 CaO + CO2↑
56 44
X 1.1克
求得X=1.4克。故选C.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环(如图1所示).某化学小组的同学设计如图2装置探究上述设想的反应原理.
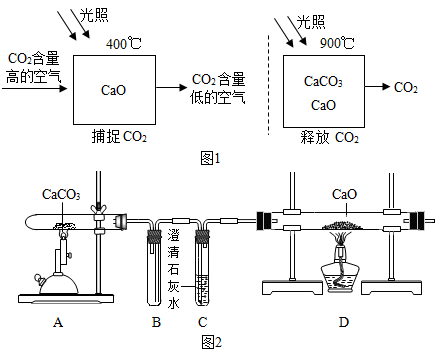
(1)能证明“释放CO2”的现象是 .
(2)装置 B的作用是 .
(3)实验后小组同学对D中固体的成分进行探究.
[查阅资料]CaO+2HCl=CaCl2+H2O
[猜想与假设]D中的固体可能为① ;② ;③ ;
[进行实验]
实验操作 | 实验现象 | 实验结论 |
猜想①正确 | ||
猜想②正确 | ||
猜想③正确 |
【题目】科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素.在四支试管中分别加入0.2克二氧化锰粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生速度,记录如下:
实验次数 | 1 | 2 | 3 | 4 |
H2O2溶液的溶质质量分数 | 1% | 5% | 10% | 15% |
MnO2质量 | 0.2克 | 0.2克 | 0.2克 | 0.2克 |
气泡产生的速度 | + | ++ | +++ | ++++ |

(1)该实验研究的问题是:过氧化氢分解的速度与 的关系.
(2)为了检验产生的气体是否为氧气,请你写出检验的方法:
(3)实验完,利用过滤法回收剩余溶液中的二氧化锰.在过滤中,下列仪器不需要的有