题目内容
【题目】某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取6.5g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下表:
实验次数 | 1 | 2 | 3 |
盐酸质量 | 5g | 5g | 5g |
氢气质量 | 0.04g | m | 0.02g |
请计算:
(1)第二次实验产生氢气的质量m___________g。
(2)黄铜(铜、锌合金)中金属铜的纯度___________。
【答案】0.04 50%
【解析】
(1)第一次加5克盐酸生成0.04克氢气,第三次加5克的盐酸还生成了0.02克的氢气,说明第二次反应中金属是过量的,也生成0.04克氢气,故答案为:0.04;
(2)共生成氢气的质量为:0.04g+0.04g+0.02g=0.1g
设生成0.1g氢气,需金属锌的质量为x。

x=3.25g
合金中铜的质量分数即纯度:![]() ×100%=50%
×100%=50%
答:黄铜(铜、锌合金)中金属铜的纯度为50%。

【题目】某化学小组通过如图所示装置,测定产生相同体积气体所用时间长短来探究影响过氧化氢分解速率的因素。
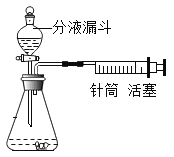
(1)简要说明如何检查如图装置的气密性_________________。
(2)实验探究
(设计实验)每次均用30mL10%的过氧化氛溶液,采用不同量的二氧化锰粉末作催化剂,测定各次收集到500mL氧气时所用的时间,结果如下:(其他实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰粉末用量/g | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
所用时间/s | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(实验结论)请分析表中数据回答:二氧化锰的用量对反应速率有没有影响呢?__________(填“有”或“无”)。如果有,是怎样影响的呢?____________。
(拓展迁移)还有哪些因素可能影响该反应的速率呢?请说出你的一个猜想:_________。简要设计实验来证明你的猜想______________。
【题目】小明同学选择“影响过氧化氢溶液分解制取氧气速率的因素”的课题开展探究。下列是他探究实验数据记录:
实验序号 | 反应温度/℃ | 催化剂二氧化锰的用量/g | 过氧化氢溶液的浓度 | 反应所需的时间/分钟 |
1 | 15 | 0 | 5% | 30 |
2 | 15 | 1g | 5% | 10 |
3 | 25 | 1g | 10% | 5 |
4 | 25 | 1g | 15% | 3 |
5 | 35 | 1g | 15% | 1 |
(1)过氧化氢溶液制取氧气反应的符号表达式为________________.
(2)实验_________________(填序号)说明二氧化锰能加快过氧化氢溶液分解放出氧气的速度;
(3)对比实验3和4,可得出的结论是______________________。
(4)通过上述对比实验得到影响过氧化氢溶液制取氧气速度的因素有___________。
A 反应的温度 B 溶液的浓度 C 催化剂的种类