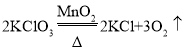题目内容
【题目】将7g含杂质的锌片(杂质不与硫酸反应)放入100g足量的稀硫酸中,反应停止后所得混合物的总质量为106. 8g。求:
(1)反应后生成H2的质量是____________________g。
(2)计算不纯的锌片中锌的质量分数。(计算结果精确到0.1%)____________
【答案】0. 2 92. 9%
【解析】
锌和硫酸反应可生成硫酸锌同时放出氢气,因此反应后剩余物质的质量减小,减小的质量即为放出氢气的质量;利用氢气的质量,根据反应的化学方程式,可计算参加反应的锌的质量,由参加反应锌的质量与样品的质量比可得锌片中锌的质量分数。
(1)由质量守恒定律可知生成氢气的质量是7g+100g-106.8g=0.2g,故填:0.2。
(2)解:设反应的锌的质量为x。
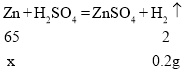
![]()
x=6.5g
锌的质量分数为:![]()
答:不纯的锌片中锌的质量分数为92. 9%。

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
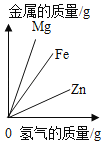
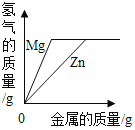
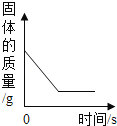
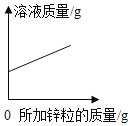
【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
Mg、Zn、Fe与稀盐酸反应 | 等质量等质量分数的盐酸与足量的镁粉、锌粉 | 将铜片加入一定量的硝酸银溶液中 | 向一定质量的氯化锌和盐酸溶液中加入锌粒 |
A. A B. B C. C D. D