题目内容
有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
| | 甲 | 乙 | 丙 |
| 取用金属混合物的质量/g | 10 | 10 | 20 |
| 取用稀硫酸的质量/g | 100 | 120 | 100 |
| 反应后过滤,得干燥固体的质量/g | 4 | 4 | 13 |
1)金属混合物中Cu的质量分数
2)计算丙同学所得溶液中溶质的质量分数(计算结果精确到0.1%)
(1)40% (2)17.8%
解析试题分析:根据题意分析,铁能与稀硫酸反应生成氢气,而铜不与稀硫酸反应,且不溶于酸;结合表格分析,比较甲、乙:分别取10g混合物,与100g硫酸和120g硫酸反应后,都剩余4g固体,即相当于在甲的基础之上,又添加了20g稀硫酸而不溶物没有减少(没有反应),则可以判断10g混合物中含有铜的质量为4g,含铁的质量为6g;再比较甲、丙:20g混合物中应含有12g铁,而它与100g硫酸反应后剩余13g固体,则说明只有7g铁与100g硫酸恰好完全反应,最后根据反应的化学方程式求硫酸亚铁的质量即可。
(1)根据表中数据可知,Cu的质量分数=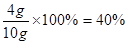
(2)根据上面的分析可知,丙同学的实验中参加反应的Fe的质量为20g-13g=7g
解:设反应生成的硫酸亚铁溶质的质量为x,反应生成的氢气的质量为y。
Fe + H2SO4 = FeSO4 + H2↑
56 152 2
7g x y
解得,x="19g" 
解得,y=0.25g
则反应后溶液质量="20g+100g-13g-0.25g=106.75g"
所以,所得溶液中溶质的质量分数=
答:丙同学所得溶液中溶质的质量分数为17.8%。
考点:根据化学反应方程式的计算
点评:此题是关于化学方程式的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要能通过数据的比较,判断出混合物中铜的质量,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
| 甲 | 乙 | 丙 | |
| 取用金属混合物的质量/g | 10 | 10 | 20 |
| 取用稀硫酸的质量/g | 100 | 120 | 100 |
| 反应后过滤,得干燥固体的质量/g | 4 | 4 | 13 |
请分析数据,回答下列问题:
(1)甲所得溶液中含有溶质的是 。
(2)根据实验数据分析,若取用金属混合物15g,加入到120g稀硫酸中,充分反应后最终得到固体质量为 。
(3)计算丙同学所得溶液中溶质的质量分数。(写出计算过程,计算结果精确到0.1%)