��Ŀ����
��2013?婽���ģ�⣩�����ۺ�ͭ�۵ľ��Ȼ����ס��ҡ�����λͬѧ�ֱ�ȡ�û������ϡ���ᷴӦ�������������±���ʾ��
��������ݣ��ش��������⣺
��1���ҳ�ַ�Ӧ�����յõ���4g������
��2�������ͬѧ������Һ�����ʵ�������������д��������̣���������ȷ��0.1%��
��3����������Һ�к��е�������
| �� | �� | �� | |
| ȡ�ý�������������/g | 10 | 10 | 20 |
| ȡ��ϡ���������/g | 100 | 120 | 100 |
| ��Ӧ����ˣ��ø�����������/g | 4 | 4 | 13 |
��1���ҳ�ַ�Ӧ�����յõ���4g������
Cu
Cu
�����ѧʽ����2�������ͬѧ������Һ�����ʵ�������������д��������̣���������ȷ��0.1%��
��3����������Һ�к��е�������
H2SO4��FeSO4
H2SO4��FeSO4
�����ѧʽ���������ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4
�ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4
����������1���Ƚϼ����������ݿ���֪��ͬ��10g�����ֱ���100gϡ���ᡢ120gϡ���ᷴӦʣ��������������4g�����Կ����ж�4g����Ϊͭ�����Ծݴ˽��
��2���Ƚϱ����е����ݿ���֪����10g�����к���ͭ������Ϊ4g����ô20g�����к���ͭ������Ϊ8g�������м���20g������100g���У�ʣ��Ĺ��������Ϊ13g�����Կ����жϽ���������е�����ʣ�࣬���Ծݴ˽�Ϸ�Ӧ�Ļ�ѧ����ʽ���м��㣻
��3���ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4�����Ծݴ˽��
��2���Ƚϱ����е����ݿ���֪����10g�����к���ͭ������Ϊ4g����ô20g�����к���ͭ������Ϊ8g�������м���20g������100g���У�ʣ��Ĺ��������Ϊ13g�����Կ����жϽ���������е�����ʣ�࣬���Ծݴ˽�Ϸ�Ӧ�Ļ�ѧ����ʽ���м��㣻
��3���ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4�����Ծݴ˽��
����⣺��1���Ƚϼ����������ݿ���֪��ͬ��10g�����ֱ���100gϡ���ᡢ120gϡ���ᷴӦʣ��������������4g�����Կ����ж�4g����Ϊͭ���仯ѧʽΪCu��
��2������������֪����Ӧ��������������Ϊ20g-13g=7g
��������������������Ϊx����������������Ϊy
Fe+H2SO4=FeSO4+H2��
56 152 2
7g x y
=
=
��ã�x=19g��y=0.25g
��Ӧ����Һ��������������������Ϊ��
��100%=17.8%��
�𣺱�ͬѧ������Һ��������������������Ϊ17.8%��
��3���ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4�����Է�Ӧ����Һ������ΪH2SO4��FeSO4��
�ʴ�Ϊ����1��Cu��
��2��7.8%��
��3��H2SO4��FeSO4���ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4��
��2������������֪����Ӧ��������������Ϊ20g-13g=7g
��������������������Ϊx����������������Ϊy
Fe+H2SO4=FeSO4+H2��
56 152 2
7g x y
| 56 |
| 7g |
| 152 |
| x |
| 2 |
| y |
��ã�x=19g��y=0.25g
��Ӧ����Һ��������������������Ϊ��
| 19g |
| 7g+100g-0.25g |
�𣺱�ͬѧ������Һ��������������������Ϊ17.8%��
��3���ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4�����Է�Ӧ����Һ������ΪH2SO4��FeSO4��
�ʴ�Ϊ����1��Cu��
��2��7.8%��
��3��H2SO4��FeSO4���ס����������ݶԱȿ�֪��������û����ȫ��Ӧ��������ϡ���ᷴӦ����FeSO4��
������������Ҫ����ѧ��������ѧ��ѧ֪ʶ�ۺϷ����ͽ��ʵ�������������������ѧ�����������˼ά��ȣ�ǿ����ѧ������֪ʶ��������

��ϰ��ϵ�д�
 �������ͬ������ϵ�д�
�������ͬ������ϵ�д�
�����Ŀ
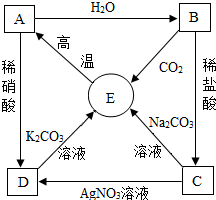 ��2013?婽���ģ�⣩A��E��Ϊ���л�ѧ�������ʣ�A��B��C��D��E������ ͬһ��Ԫ�أ�B�����ڸ�����������������֮����ת����ϵ��ͼ��ʾ����ͼ�С�������ʾ���ʼ����ת����ϵ���������������� ȥ������ش��������⣺
��2013?婽���ģ�⣩A��E��Ϊ���л�ѧ�������ʣ�A��B��C��D��E������ ͬһ��Ԫ�أ�B�����ڸ�����������������֮����ת����ϵ��ͼ��ʾ����ͼ�С�������ʾ���ʼ����ת����ϵ���������������� ȥ������ش��������⣺