��Ŀ����
����Ŀ����ˮ�к��зḻ��þ��Ŀǰ������������þ60%�����ں�ˮ�������ʳ�εĺ�ˮ������±ˮ�����к��зḻ��MgCl2����ҵ���Կ�±ˮΪԭ����ȡ����þ���������£�
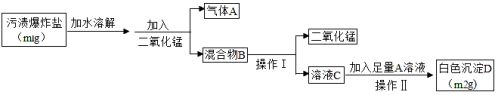
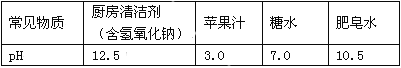
(1)д���������з�����Ӧ�Ļ�ѧ����ʽ___________________��________________________��
(2)Y��Z��Ӧ��IJ�������ˮ�ɵ�X��Һ���Ӷ�ʵ����Y��ѭ�����ã���Z�Ļ�ѧʽΪ________��X��Һ��������________��
(3)��ɺ�õ���MgCl2�п��ܺ��е�������________��
���𰸡� CaO��H2O===Ca(OH)2 Ca(OH)2��MgCl2===Mg(OH)2����CaCl2 H2 ϡ���ᡡ CaCl2��
��������������������������֪XΪ���ᡢ����YΪ����������Z��������1���������з�����Ӧ�Ļ�ѧ����ʽΪCaO + H2O ="=" Ca(OH)2��MgCl2+Ca(OH)2=Mg(OH)2��+CaCl2��2��Y��Z��Ӧ��IJ�������ˮ�ɵ�X��Һ���Ӷ�ʵ����Y��ѭ�����ã���Z�Ļ�ѧʽΪH2��X��Һ�������������3����ɺ�õ���MgCl2�п��ܺ��е��������Ȼ��ơ�

��ϰ��ϵ�д�
 ����ѧ����ϵ�д�
����ѧ����ϵ�д�
�����Ŀ