题目内容
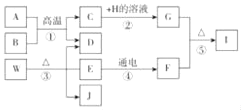
【题目】如图为实验室制取某些常见气体的装置图,请回答下列问题。
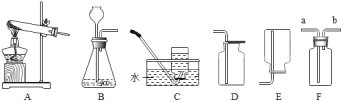
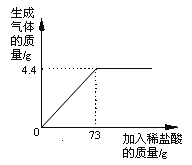
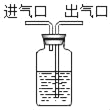
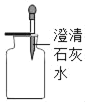
(1)若选用A装置作为发生装置用高锰酸钾制取氧气,则有一处需要改进,其目的是_____;反应的文字表达式为_____。收集氧气可用D装置的原因是_____。还可选用C装置收集氧气,若用C装置收集氧气,请简述判断氧气已收集满的方法:_____。采用这种集气法收集的氧气不纯的原因可能是_____ (答出一点即可)。
(2)实验室用双氧水制氧气的文字表达式为_____。若用双氧水制氧气,可选用的发生装置是_____(填装置序号). 如需随时控制反应速率并节约药品可将B装置中的_____(填仪器名称)换成_____(填仪器名称).若选用F装置用于排空气法收集氧气,氧气应从_____端(选填“a”或“b”,下同)通入;若选用F装置用于排水法收集氧气,瓶中先装满水,则氧气应从_____ 端通入。
(3)天然气的主要成分是甲烷,甲烷是一种密度比空气小、难溶于水的气体。实验室常用无水醋酸钠固体和碱石灰固体共同加热制取甲烷,应选择的发生装置是_____ (选填装置序号),收集装置可选_____,理由是_____。
【答案】(1)防止高锰酸钾颗粒进入导管, 高锰酸钾 → 锰酸钾 + 二氧化锰 + 氧气
氧气的密度大于空气 气泡从瓶口往外逸 集气瓶没装满水(或没等气泡连续而均匀冒出时就收集了等合理即可)
(2)过氧化氢 → 水 + 氧气 B 长颈漏斗 分液漏斗 a b
(3)A C(或E) 难溶于水(或密度小于空气)
【解析】
(1)加热高锰酸钾制取氧气时,要在试管口内放一团棉花,防止高锰酸钾颗粒进入导管,降低氧气的纯度,故填防止高锰酸钾颗粒进入导管;
高锰酸钾受热反应生成锰酸钾、二氧化锰和氧气,故文字表达式写为高锰酸钾![]() 锰酸钾+二氧化锰+氧气;
锰酸钾+二氧化锰+氧气;
D为向上排空气法,向上排空气法用来收集密度大于空气的气体,故填氧气的密度大于空气;
C为排水法收集气体,排水法收集气体收集满时会看到气泡从瓶口向外逸出,故填气泡从瓶口往外逸出;
用排水法收集氧气,如果收集到的氧气不纯,其原因可能是:没有等到气泡均匀连续地冒出就收集,或集气瓶中没有装满水,故填集气瓶没装满水(或没等气泡连续而均匀冒出时就收集了等合理即可)。
(2)双氧水制取氧气时,过氧化氢在二氧化锰做催化剂的条件下反应生成水和氧气,故文字表达式写为过氧化氢![]() 水+氧气;
水+氧气;
双氧水制取氧气是固体和液体不需加热制取气体,发生装置选择固液常温发生装置,故填B;
固液常温发生装置中,如需随时控制反应速率并节约药品可以将长颈漏斗换为分液漏斗,故填将长颈漏斗换为分液漏斗;
氧气的密度大于空气的密度,若选用F装置用于排空气法收集氧气,氧气应从长管通道集气瓶的底部,故填a;
氧气的密度小于水的密度,若选用F装置用于排水法收集氧气,瓶中先装满水,氧气从短管通入瓶中,将水从长管压出瓶外,故填b。
(3)无水醋酸钠固体和碱石灰固体共同加热制取甲烷是固体受热生成气体,需要加热,故填A;
甲烷是一种密度比空气小、难溶于水的气体,收集甲烷既能用向下排空气法,也可以用排水法,故填C(或E);
理由故填难溶于水(或密度小于空气)。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】生活中常遇见铜制品生锈的情况.活动课上,同学们设计实验对铜锈进行了如下探究活动.
探究活动一:验证铜锈的组成
【査阅资料】①铜锈为绿色,其主要成分是Cu2(OH)2CO3.②白色的硫酸铜粉末遇水能变为蓝色.③碳不与稀硫酸反应.④氧化铜为黑色固体,能与稀硫酸反应生成硫酸铜溶液.
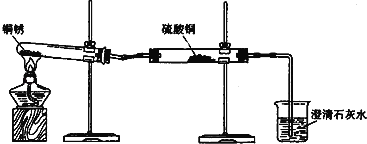
【进行实验1】同学们设计了如图所示装置并进行实验.
实验橾作 | 实验现象 | 实验结论 |
①按如图组装仪器,装入药品. ②加热铜锈,直至不再有气体产生,停止加热. | 绿色固体变为黑色;硫酸铜粉末变为蓝色;烧杯中液体变浑浊. | 加热铜锈生成的物质有 ; 铜绣由 元素组成; 烧杯中发生反应的化学方程式为 . |
③冷却后,向试管中固体 加入适量稀硫酸,稍加热. | 黑色固体溶解,溶液变 为蓝色. |
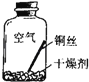
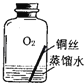
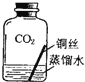
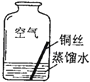
【进行实验2】同学们进行了下面的4个实验,每天观察一次现象,一段时间后,发现只有实验4中的铜丝生锈了,且与水接触的部分生锈更明显.
序号 | 实验内容 | 实验结论 | 实验反思 |
实验1 |
| 在干燥环境中,铜不易生锈 | (1)实验2和3中使用的是经煮沸后迅速冷却的蒸馏水,其原因是 . (2)如果要证明铜生锈的快慢是否与二氧化碳的浓度有关,还需要补充的一个实验内容是 |
实验2 |
| ||
实验3 |
| ||
实验4 |
| 铜生锈的条件是
|