题目内容
超氧化钾(KO2)是一种黄色固体,它能与二氧化碳反应生产氧气,在潜水艇中用它作制氧剂,供人们呼吸之用.
反应方程式:4KO2+2CO2=2K2CO3+3O2
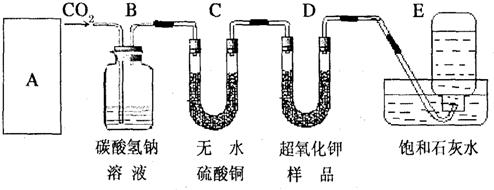
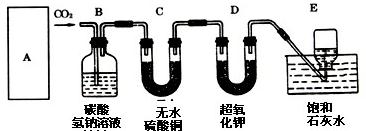
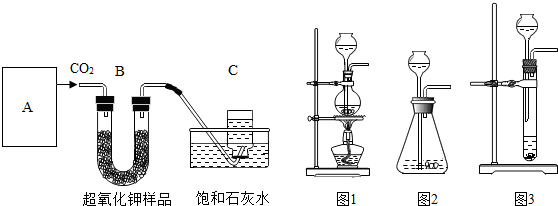
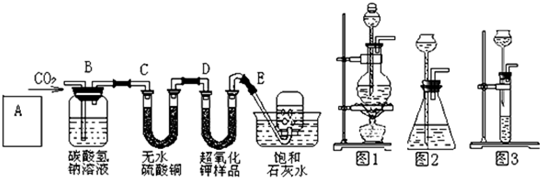
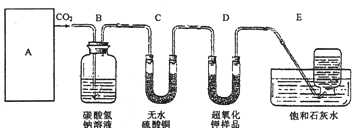
某学生为了验证这一实验,以大理石、足量的盐酸和超氧化钾为原料制取O2,设计出如下实验装置: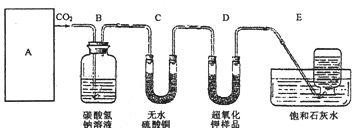
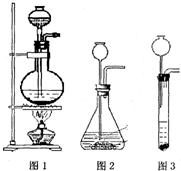
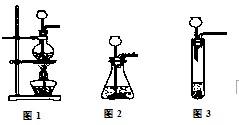
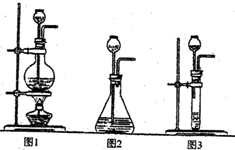
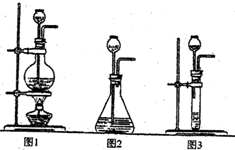
(1)A是制取CO2的装置,应从下列图1、图2、图3中选择______.
B装置的作用是吸收A装置产生的盐酸酸雾,C装置内可能出现的现象是:______;
(2)若E中的石灰水出现少量的白色沉淀,这是因为:______;
(3)表明D中超氧化钾样品接近反应完毕时的现象是:______;
(4)在A中加入8克碳酸钙与足量盐酸完全反应后,如果生成的气体全部被超氧化钾吸收,D装置质量______(填“增加”或“减少”)______克.但实验时称量D,发现反应后其质量该变量明显与理论值不符,可能原因是______
A、生成的CO2部分残留在A、B、C装置里未被D装置吸收
B、D装置后面的水蒸气进入被超氧化钾吸收
C、超氧化钾不足量
D、挥发的盐酸与碳酸氢钠反应生成的CO2也被D装置吸收.
解:(1)制取二氧化碳时用的大理石和稀盐酸,是固体和液体常温制气体,所以可选择图2来进行.
白色的无水硫酸铜与水反应生成蓝色晶体. 故答案为:图2;白色固体变蓝;
(2)E水槽中是澄清石灰水出现浑浊即前面的装置中导出了二氧化碳.故答案为:D中有少量CO2未参加反应并随气体进入E中生成CaCO3.
(3)超氧化钾反应完毕会有大量的二氧化碳通入到石灰水中.故答案为:E中浑浊明显增加.
(4)设8克碳酸钙与足量盐酸完全反应生成的二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
8g x

x=3.52g
由4KO2+2CO2=2K2CO3+3O2知,过氧化钾吸收两份的二氧化碳而生成三份的氧气,所以质量减少32×3-44×2=8,所以设过氧化钾吸收3.52g二氧化碳,质量减少为y,
4KO2+2CO2=2K2CO3+3O2 减少的质量
88 96 8
3.52g y
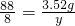
y=0.32g
在实验时称量D,发现反应后其质量该变量明显与理论值不符,是因为二氧化碳量的多少造成的,所以影响生成的二氧化碳气体的量的都会影响,故选AC,右侧的水蒸气可以超氧化钾接触,所以B正确.因为挥发的盐酸与碳酸氢钠反应生成的CO2也被D装置吸收,所以D也正确.故答案为:减少; 0.32;ABCD;
分析:(1)利用大理石与盐酸制取二氧化碳属固液型制气装置; 无水硫酸铜与水反应变蓝;
(2)E水槽中是澄清石灰水出现浑浊即前面的装置中导出了二氧化碳;
(3)超氧化钾反应完毕会有大量的二氧化碳通入到石灰水中;
(4)根据8克碳酸钙与足量盐酸完全反应可求出二氧化碳的质量,然后根据方程式4KO2+2CO2=2K2CO3+3O2
,用差量法求出减少的质量,最后根据题意找出与与理论值不符的原因.
点评:误差分析既要考虑装置本身的问题,又要考虑实验原理的问题,有时实验设计原理本身就是有缺陷的.
白色的无水硫酸铜与水反应生成蓝色晶体. 故答案为:图2;白色固体变蓝;
(2)E水槽中是澄清石灰水出现浑浊即前面的装置中导出了二氧化碳.故答案为:D中有少量CO2未参加反应并随气体进入E中生成CaCO3.
(3)超氧化钾反应完毕会有大量的二氧化碳通入到石灰水中.故答案为:E中浑浊明显增加.
(4)设8克碳酸钙与足量盐酸完全反应生成的二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
8g x

x=3.52g
由4KO2+2CO2=2K2CO3+3O2知,过氧化钾吸收两份的二氧化碳而生成三份的氧气,所以质量减少32×3-44×2=8,所以设过氧化钾吸收3.52g二氧化碳,质量减少为y,
4KO2+2CO2=2K2CO3+3O2 减少的质量
88 96 8
3.52g y
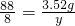
y=0.32g
在实验时称量D,发现反应后其质量该变量明显与理论值不符,是因为二氧化碳量的多少造成的,所以影响生成的二氧化碳气体的量的都会影响,故选AC,右侧的水蒸气可以超氧化钾接触,所以B正确.因为挥发的盐酸与碳酸氢钠反应生成的CO2也被D装置吸收,所以D也正确.故答案为:减少; 0.32;ABCD;
分析:(1)利用大理石与盐酸制取二氧化碳属固液型制气装置; 无水硫酸铜与水反应变蓝;
(2)E水槽中是澄清石灰水出现浑浊即前面的装置中导出了二氧化碳;
(3)超氧化钾反应完毕会有大量的二氧化碳通入到石灰水中;
(4)根据8克碳酸钙与足量盐酸完全反应可求出二氧化碳的质量,然后根据方程式4KO2+2CO2=2K2CO3+3O2
,用差量法求出减少的质量,最后根据题意找出与与理论值不符的原因.
点评:误差分析既要考虑装置本身的问题,又要考虑实验原理的问题,有时实验设计原理本身就是有缺陷的.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目