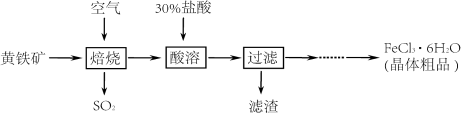
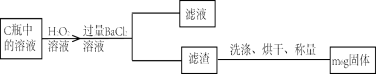
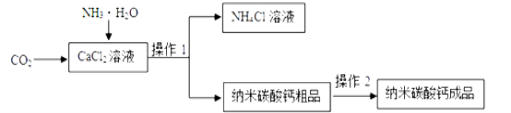
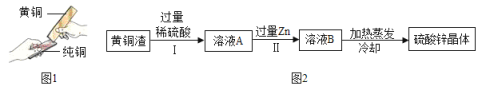
题目内容
【题目】在20℃时,刘冰同学向100g水中依次加入氯化钠固体,充分溶解,实验过程如图所示,下列说法错误的是
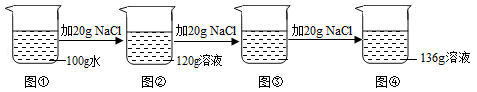
A.20℃时,氯化钠的溶解度是36g
B.图②中溶液是不饱和溶液
C.图③中溶液的溶质质量为40g
D.图③和图④中NaCl溶液的溶质质量分数相等
【答案】C
【解析】
试题分析:A.从图可以看出,20℃时,100g水中加入40g氯化钠固体,最终所得溶液质量为136g,说明该温度下,100g水中最多只能溶解36g氯化钠,因此20℃时NaCl的溶解度为36g,故说法正确;
B.由A分析可知,20℃时,100g水中最多溶解36g氯化钠,图②中的溶液是120g,其中溶剂水的质量是100g,说明100g水中只溶解了20g氯化钠,是不饱和溶液,故说法正确;
C.已知,20℃时,100g水中最多溶解36g氯化钠,图③中,100g水中加入了40g氯化钠,只能溶解36g,因此图③中溶液的溶质质量为36g,故说法错误;
D、图③和图④溶液中都有NaC晶体存在,溶液都是饱和溶液,根据该温度下饱和溶液中溶质质量分数计算公式可得:溶质质量分数=![]() ,D说法正确。故选C
,D说法正确。故选C

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
【题目】下表列出了除去物质中所含少量杂质的方法,其中错误的是
选项 | 物质 | 所含杂质 | 除去杂质的方法 |
A | CO | CO2 | 将气体缓缓通过足量的澄清石灰水,并干燥 |
B | CO2 | CO | 将混合气体点燃 |
C | Cu | Zn | 加入过量的稀盐酸,过滤,洗涤,加热烘干 |
D | FeCl2溶液 | CuCl2 | 加入过量的铁粉,过滤 |