题目内容
【题目】某化学兴趣小组的同学在做氢氧化钙与稀盐酸中和反应的实验时,忘记滴加指示剂,因而无法判断酸碱是否恰好完全反应。于是他们对反应后溶液中的溶质大胆提出猜想,进行了以下探究,请你和他们一起完成下列实验报告。
Ⅰ.定性探究
【提出问题】该溶液中的溶质含有哪些成分?
【查阅资料】CaCl2溶液呈中性。
【猜想与假设】
猜想Ⅰ:溶液中的溶质只有___________________
猜想Ⅱ:溶液中的溶质有CaCl2、HCl
猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2
猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl
(1)请写出该反应的化学方程式_________________________。经过讨论,同学们直接得
出不合理的猜想是哪一种并说出理由_____________________________________。为了验
证余下的哪一种猜想是正确的,同学们又做了以下实验。
【进行实验】
(2)
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 | __________________ | 猜想Ⅲ不正确 |
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠 | 有气泡产生 | 猜想_______不正确 猜想_______正确 |
(3)操作②有气泡生成的化学方程式为_________________________。
(4)下列曲线能够表示所做实验中溶液pH变化趋势的是________(填序号)。

【反思交流】
(5)要使烧杯内溶液的溶质只含CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的_______________,然后过滤。
II.定量探究
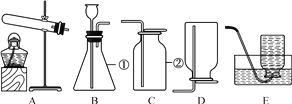
(6)兴趣小组同学想对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为20%的氢氧化钙溶液进行中和,如下图所示.请你计算废水中盐酸的溶质质量分数__________.(写出具体的计算过程 )

【答案】 CaCl2 2HCl+ Ca(OH)2== CaCl2+2H2O HCl与 Ca(OH)2不能共存 不变色 Ⅲ Ⅱ 方程式略 D 碳酸钙 略
【解析】Ⅰ.定性探究【提出问题】该溶液中的溶质含有哪些成分?【查阅资料】CaCl2溶液呈中性。猜想Ⅰ:溶液中的溶质只有CaCl2 。猜想Ⅱ:溶液中的溶质有CaCl2、HCl。猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2。。猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl。(1)该反应的化学方程式是2HCl+ Ca(OH)2== CaCl2+2H2O。经过讨论,同学们直接得出不合理的猜想是猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl。理由是HCl与 Ca(OH)2不能共存。为了验证余下的哪一种猜想是正确的,【进行实验】
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 | 不变色 | 猜想Ⅲ不正确 |
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠 | 有气泡产生 | 猜想Ⅲ不正确 猜想Ⅱ正确 |
(3)操作②有气泡生成的化学方程式为Na2CO3+2HCl=2NaCl+H2O +CO2↑。
(4)下列曲线能够表示所做实验中溶液pH变化趋势的是D。 【反思交流】
(5)要使烧杯内溶液的溶质只含CaCl2,需要除去杂质,其中的一种方法是向烧杯中加入过量的碳酸钙,然后过滤。II.定量探究(6)
解∶设参加反应的HCl质量为xg
2HCl+ Ca(OH)2== CaCl2+2H2O
73 74
x 20%×37g
![]() =
=![]()
x=7.3g.
废水中盐酸的溶质质量分数∶![]() ×100%=14.6%。
×100%=14.6%。
答∶废水中盐酸的溶质质量分数是14.6%。
点睛∶本题是一道实验探究题,主要考查氢氧化钙与稀盐酸中和反应的进程以及根据化学方程式进行计算。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案