题目内容
实验室有一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质的质量分数为10%,具体是什么物质的溶液无法辨认,只知道可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠溶液中的一种.化学兴趣小组的同学进行如下探究,请你共同参与:
【查阅资料】小组同学查阅了相关资料,得知四种物质在常温下的溶解度如下表所示:
| 氢氧化钠 | 氯化钠 | 氢氧化钙 | 碳酸钠 | |
| 溶解度/g(20℃) | 51 | 36 | 0.16 | 21.5 |
(2)取少量样品溶液于试管中,滴加________试液,试液变红色,该溶液不可能是________溶液,你的理由是:________.
(3)为了确定该溶液的成分,继续进行下列实验:
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成分;
方案乙:选择稀盐酸来确定该溶液的成分.
【进行实验】你更愿意选择方案________(选填:“甲”或“乙”)进行实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品溶液于试管中,滴加________. | ________ | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: ________. |
(2)通过实验探究,小组同学提出了如下一些建议,其中合理的是________(填序号).
A.倾倒液体时应注意保护标签不被腐蚀
B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留.
解:(1)常温下氢氧化钙的溶解度为0.18g,其饱和溶液中溶质质量分数=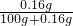 ×100%<0.16%,而该溶液溶质质量分数为10%,故不可能是氢氧化钙溶液;
×100%<0.16%,而该溶液溶质质量分数为10%,故不可能是氢氧化钙溶液;
(2)往该溶液中加入无色酚酞试液会变成红色,可知溶液显碱性;剩下的氢氧化钠、氯化钠、碳酸钠溶液三种溶液中氢氧化钠、碳酸钠溶液显碱性,而氯化钠溶液显中性,故不可能是氯化钠;
(3)若选用的是甲方案,氯化钙溶液与碳酸钠溶液反应生成碳酸钙白色沉淀和氯化钠,现象是有白色沉淀生成,反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
若选用的是乙方案,稀盐酸与碳酸钠溶液反应生成氯化钠、水、二氧化碳气体,现象是有气泡产生,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
【实验反思】(1)碳酸钠溶液与澄清石灰水反应生成碳酸钙白色沉淀,故可用氢氧化钙溶液确定溶液的组成,有白色沉淀生成是碳酸钠溶液,无明显现象是氢氧化钠溶液,反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)倾倒液体时应注意保护标签不被腐蚀,故A合理;要有严谨的科学实验的态度,故B合理;对于标签被腐蚀的试剂,本着节约原则,应尽可能确定药品的组成,不可随意扔弃,既不安全又造成浪费;故C不合理;故选AB.
故答案为:(1)氢氧化钙;
(2)酚酞;NaCl;氯化钠溶液呈中性,不能使酚酞试液变红;
(3)乙;稀盐酸;有气泡产生;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
【实验反思】(1)Ca(OH)2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)AB.
分析:(1)根据氢氧化钙溶解度与饱和溶液的溶质质量分数的关系进行分析解答;
(2)该溶液能使无色酚酞试液变红,说明显碱性,根据氢氧化钠、氯化钠、碳酸钠溶液的酸碱性进行解答;
(3)检验氢氧化钠和碳酸钠,采用的是氯化钙溶液或稀盐酸等能于碳酸钠溶液反应产生白色沉淀或产生气体的物质,根据实验结论确定实验现象即可;
【实验反思】(1)根据碳酸钠的性质,判断能与碳酸钠反应且有明显反应现象的碱溶液;
(2)根据节约药品的原则,评价对于无法辨认的药品的处理方法进行解答.
点评:本题难度较大,可采取“利用测定结果进行先排除,最后进行实验检验”的思路确定未知溶液,解题的关键是熟练掌握氢氧化钠、氯化钠、氢氧化钙、碳酸钠的性质.
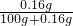 ×100%<0.16%,而该溶液溶质质量分数为10%,故不可能是氢氧化钙溶液;
×100%<0.16%,而该溶液溶质质量分数为10%,故不可能是氢氧化钙溶液;(2)往该溶液中加入无色酚酞试液会变成红色,可知溶液显碱性;剩下的氢氧化钠、氯化钠、碳酸钠溶液三种溶液中氢氧化钠、碳酸钠溶液显碱性,而氯化钠溶液显中性,故不可能是氯化钠;
(3)若选用的是甲方案,氯化钙溶液与碳酸钠溶液反应生成碳酸钙白色沉淀和氯化钠,现象是有白色沉淀生成,反应的化学方程式为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
若选用的是乙方案,稀盐酸与碳酸钠溶液反应生成氯化钠、水、二氧化碳气体,现象是有气泡产生,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
【实验反思】(1)碳酸钠溶液与澄清石灰水反应生成碳酸钙白色沉淀,故可用氢氧化钙溶液确定溶液的组成,有白色沉淀生成是碳酸钠溶液,无明显现象是氢氧化钠溶液,反应的化学方程式为Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)倾倒液体时应注意保护标签不被腐蚀,故A合理;要有严谨的科学实验的态度,故B合理;对于标签被腐蚀的试剂,本着节约原则,应尽可能确定药品的组成,不可随意扔弃,既不安全又造成浪费;故C不合理;故选AB.
故答案为:(1)氢氧化钙;
(2)酚酞;NaCl;氯化钠溶液呈中性,不能使酚酞试液变红;
(3)乙;稀盐酸;有气泡产生;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
【实验反思】(1)Ca(OH)2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)AB.
分析:(1)根据氢氧化钙溶解度与饱和溶液的溶质质量分数的关系进行分析解答;
(2)该溶液能使无色酚酞试液变红,说明显碱性,根据氢氧化钠、氯化钠、碳酸钠溶液的酸碱性进行解答;
(3)检验氢氧化钠和碳酸钠,采用的是氯化钙溶液或稀盐酸等能于碳酸钠溶液反应产生白色沉淀或产生气体的物质,根据实验结论确定实验现象即可;
【实验反思】(1)根据碳酸钠的性质,判断能与碳酸钠反应且有明显反应现象的碱溶液;
(2)根据节约药品的原则,评价对于无法辨认的药品的处理方法进行解答.
点评:本题难度较大,可采取“利用测定结果进行先排除,最后进行实验检验”的思路确定未知溶液,解题的关键是熟练掌握氢氧化钠、氯化钠、氢氧化钙、碳酸钠的性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 小华同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损(如右图所示).老师告诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸镁溶液中的一种.小华同学通过查阅资料得知,常温下这三种物质的溶解度如下表:
小华同学在化学实验室发现一瓶盛有无色溶液的试剂瓶,其标签严重破损(如右图所示).老师告诉他,这瓶试剂可能是硫酸、硫酸钠、硫酸镁溶液中的一种.小华同学通过查阅资料得知,常温下这三种物质的溶解度如下表:| 物质 | H2SO4 | Na2SO4 | MgSO4 |
| 溶解度/g | 与水任意比互溶 | 19.0 | 39.0 |
(1)提出假设:假设1:该溶液可能是
(2)设计实验方案;基于假设2设计实验方案(不必写出)
(3)实验过程
| 实验步骤 | 实验现象 | 实验结论 |
实验室有一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质的质量分数为10%,具体是什么物质的溶液无法辨认,只知道可能是氢氧化钠、氯化钠、氢氧化钙或碳酸钠溶液中的一种.化学兴趣小组的同学进行如下探究,请你共同参与:
【查阅资料】小组同学查阅了相关资料,得知四种物质在常温下的溶解度如下表所示:
(1)小组同学经过讨论,认为该溶液不可能是______溶液.
(2)取少量样品溶液于试管中,滴加______试液,试液变红色,该溶液不可能是______溶液,你的理由是:______.
(3)为了确定该溶液的成分,继续进行下列实验:
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成分;
方案乙:选择稀盐酸来确定该溶液的成分.
【进行实验】你更愿意选择方案______(选填:“甲”或“乙”)进行实验.
【实验反思】(1)小组同学认为还可以用一种常见的碱溶液来确定,它是______溶液,反应的化学方程式为______.
(2)通过实验探究,小组同学提出了如下一些建议,其中合理的是______(填序号).
A.倾倒液体时应注意保护标签不被腐蚀
B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留.
【查阅资料】小组同学查阅了相关资料,得知四种物质在常温下的溶解度如下表所示:
| 氢氧化钠 | 氯化钠 | 氢氧化钙 | 碳酸钠 | |
| 溶解度/g(20℃) | 51 | 36 | 0.16 | 21.5 |
(2)取少量样品溶液于试管中,滴加______试液,试液变红色,该溶液不可能是______溶液,你的理由是:______.
(3)为了确定该溶液的成分,继续进行下列实验:
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成分;
方案乙:选择稀盐酸来确定该溶液的成分.
【进行实验】你更愿意选择方案______(选填:“甲”或“乙”)进行实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量样品溶液于试管中,滴加______. | ______ | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: ______. |
(2)通过实验探究,小组同学提出了如下一些建议,其中合理的是______(填序号).
A.倾倒液体时应注意保护标签不被腐蚀
B.要有严谨的科学实验的态度
C.无法辨认的药品,直接倒掉,无需保留.