题目内容
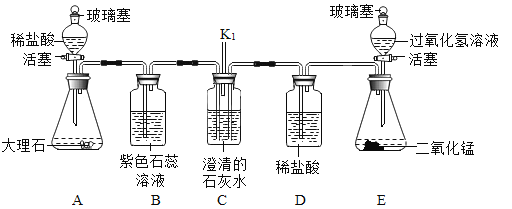
【题目】根据下列实验装置图,回答有关问题,
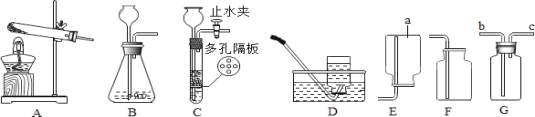
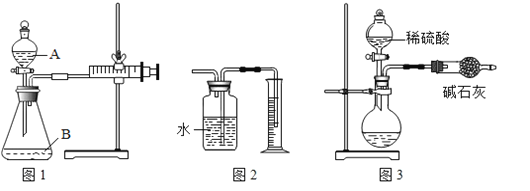
(1)装置图中仪器a的名称为_____。
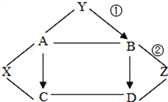
(2)用氯酸钾和二氧化锰混合制取氧气,可选用的发生装置是_____(填字母),写出该反应的化学方程式_____;若用D装置收集氧气,当导管口气泡_____冒出时,再把导管口伸入盛满水的集气瓶。
(3)实验室用B装置制取二氧化碳的化学方程式为_____,如果用G装置收集气体,气体应从_____(填“b”或“c”)端通入;用C装置代替B装置,收集所需的气体量后,对C装置进行的操作是_____。
(4)“微观—宏观—符号”三重表征是化学独特的表示物质及其变化的方法。某校甲、乙两个研究性学习小组进行“硫酸铜和氢氧化钠相关反应”的实验,实验过程和微观示意图如下。
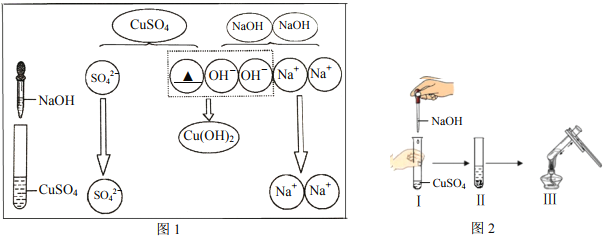
请结合上图回答问题:
①写出图1中“▲”处对应的粒子符号_____。
②他们记录下图2实验中的现象:
甲组:II处产生蓝色沉淀,写出该反应的化学方程式_____。III处_____;
乙组:II处产生蓝白色沉淀,III处没有变化。
③查阅资料可知:在酸性条件下,硫酸铜和氢氧化钠反应生成蓝白色的碱式硫酸铜固体,硫酸铜溶液的pH﹤7。分析造成乙组现象的可能原因是_____。
【答案】集气瓶 A 2KClO3![]() 2KCl+3O2↑ 连续均匀 CaCO3+2HCl===CaCl2+H2O+CO2↑ b 关闭止水夹 Cu2+ CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 有黑色物质生成 硫酸铜溶液过量且碱式硫酸铜受热不分解
2KCl+3O2↑ 连续均匀 CaCO3+2HCl===CaCl2+H2O+CO2↑ b 关闭止水夹 Cu2+ CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 有黑色物质生成 硫酸铜溶液过量且碱式硫酸铜受热不分解
【解析】
(1)装置图中仪器a的名称为集气瓶;
(2)用氯酸钾和二氧化锰混合制取氧气时,该反应的反应物是固体,反应条件是加热,应选用的发生装置是A;氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为2KClO3![]() 2KCl+3O2↑;若用D装置收集氧气,当导管口气泡连续均匀冒出时,再把导管口伸入盛满水的集气瓶;
2KCl+3O2↑;若用D装置收集氧气,当导管口气泡连续均匀冒出时,再把导管口伸入盛满水的集气瓶;
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,大理石或石灰石的主要成分是碳酸钙,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,化学方程式为:CaCO3+2HCl===CaCl2+H2O+CO2↑;二氧化碳的密度大于空气,如果用G装置收集气体,气体应从b端通入;用C装置代替B装置,收集所需的气体量后,下一步通过操作使反应停止,关闭止水夹后,试管内的气压增大,会液体压回长颈漏斗,固体与液体脱离接触,反应停止,所以对C装置进行的操作是关闭止水夹;
(4)①硫酸铜是由铜离子和硫酸根离子组成,图1中“▲”处对应的粒子符号Cu2+;
②甲组II处产生蓝色沉淀是由硫酸铜与氢氧化钠反应生成硫酸钠和氢氧化铜生成的,该反应的化学方程式为:CuSO4+2NaOH==Cu(OH)2↓+Na2SO4;III处反应的反应是氢氧化铜加热生成氧化铜和水,实验现象是有黑色物质生成;
③查阅资料可知:在酸性条件下,硫酸铜和氢氧化钠反应生成蓝白色的碱式硫酸铜固体,硫酸铜溶液的pH﹤7。造成乙组现象的可能原因是硫酸铜溶液过量且碱式硫酸铜受热不分解。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案