题目内容
【题目】鸡蛋壳的主要成分是碳酸钙。某学生想测定鸡蛋壳中碳酸钙的质量分数,取15g干燥的碎鸡蛋壳放入烧杯中,向其中加入40g稀盐酸至恰好完全反应(假设鸡蛋壳中除碳酸钙外的其它成分都不溶于水,且不与稀盐酸反应),反应后烧杯中物质的总质量为50.6g。
(1)生成二氧化碳的质量是________g。
(2)计算鸡蛋壳中碳酸钙的质量分数_________(结果保留1位小数)。
【答案】4.4 66.7%
【解析】
根据质量守恒定律可知,反应前后物质的总质量不变,反应前物质的总质量为:15g(干燥的碎鸡蛋壳)+40g(稀盐酸)=55g,而反应后烧杯中物质的总质量50.6g,这说明反应过程中生成了55g-50.6g=4.4 g的气体,此气体为二氧化碳。因此在反应中生成二氧化碳的质量为4.4 g,可求出参加反应的碳酸钙的质量,然后再求出碳酸钙在鸡蛋壳中所占的质量分数。
(1)生成二氧化碳的质量为:40g+15g-50.6g=4.4g,生成二氧化碳的质量为4.4 g。
(2)解:设15g鸡蛋壳中碳酸钙的质量为x,
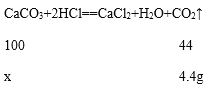
![]() 得x=10g,
得x=10g,
鸡蛋壳中碳酸钙的质量分数为:![]() =66.7%
=66.7%
答:鸡蛋壳中碳酸钙的质量分数为66.7%。

 名校课堂系列答案
名校课堂系列答案【题目】(1)四种铁矿石的主要成分是:①Fe2O3 ②Fe3O4 ③FeCO3 ④FeS2,这四种化合物含铁的质量分数由高到低的顺序是_____________(填序号)。
(2)近年来,有不法分子利用假金欺骗群众,假金外观像黄金,但它是一种铜与金属M的合金。某同学想确定金属M,已知金属M为+2价,他取用3.5 g这种假金样品,把15.0g含HCl14.6%的稀盐酸分3次加入,充分反应后剩余固体质量见表:
第1次 | 第2次 | 第3次 | |
稀盐酸的用量/g | 5.0 | 5.0 | 5.0 |
剩余固体质量/g | 2.85 | 2.2 | 2.0 |
①计算该假金样品中铜的质量分数______;
②通过计算确定M是何种金属__________。