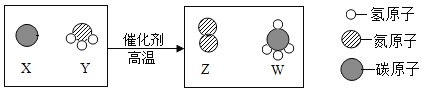
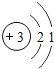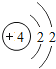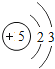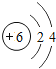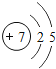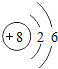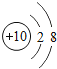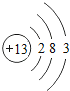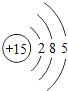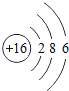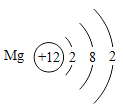题目内容
【题目】水和溶液对于人类的生产和生命活动有重大的意义。

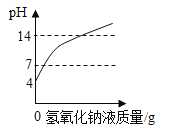
(1)上图为某自来水厂生产的主要步骤,可以除去河水固体杂质的是_______________,经过上述处理后的水有可能是硬水,在日常生活中常采用________________方法使硬水软化。
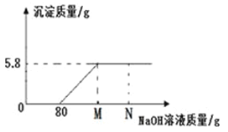
(2)现要配制 l00 g 12%的氯化钠溶液,称量过程中误将砝码(砝码规格有 50g、20g、10g、5g,称量时 5g 以下用游码)和称量物放反了,其他过程没有错误,则实际配制溶液中溶质的质量分数为___________。
【答案】C(或者过滤) 煮沸 8.3%
【解析】
(1)过滤可以分离不溶性固体和液体,可以除去河水固体杂质的是过滤,经过上述处理后的水有可能是硬水,在日常生活中常采用加热、煮沸方法使硬水软化,因为煮沸过程中钙、镁离子会形成沉淀。
(2)现要配制 l00 g 12%的氯化钠溶液,则氯化钠的质量=100g×12%=12g,需要水的质量=100g+-12g=88g;称量过程中误将砝码和称量物放反了,左盘(10g砝码)=右盘(药品质量)+2g(游码),氯化钠的实际质量=10g-2g=8g,其他过程没有错误,则实际配制溶液中溶质的质量分数=![]() 。
。

 快乐5加2金卷系列答案
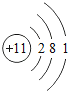
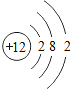
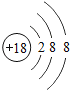
快乐5加2金卷系列答案【题目】核电荷数为1﹣18的原子结构示意图等信息如下,请回答下列问题:
第一周期 | 1H
| 2He
| |||||||
第二周期 | 3Li
| 4Be
| 5B
| 6C
| 7N
| 8O
| 9F
| 10Ne
| |
第三周期 | 11Na
| 12Mg
| 13Al
| 14Si
| 15P
| 16S
| 17Cl
| 18Ar
| |
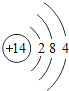
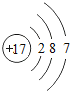
(1)不同种元素最本质的区别是_____(选填序号)
A质子数不同 B最外层电子数不同 C中子数不同 D相对原子质量不同
(2)在第三周期中,各原子结构的共同之处是_____;该周期中,各原子核外电子排布的变化规律是_____.
(3)在第三周期中,元素类型的变化情况是:从左到右由_____元素过渡到_____元素,并以稀有气体元素结尾.
(4)写出核外电子排布与氖原子相同的阳离子和阴离子各一个:阳离子_____,阴离子_____.