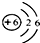题目内容
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
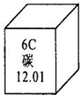
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.(1)右图为元素周期表中的一格,下列说法不正确的是
D
D
(填标号).A.碳元素属于非金属元素
B.碳原子核内质子数为6
C.碳元素的原子结构示示意图为
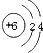
D.碳的相对原子质量为12.01g
(2)实验室中,利用下列装置可以制取气体,请回答下列问题.
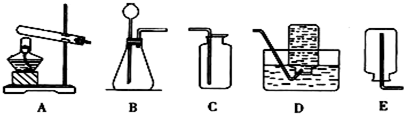
①用大理石和稀盐酸反应制取CO2,应选用的发生装置是(填代号,下同)
B
B
,最好选用的收集装置是C
C
.②加热固体碳酸氢钠和固体碳酸氢铵都能产生CO2,其化学方程式分别是:
2NaHCO3
| ||
| ||
某同学采用加热固体碳酸氢钠的方法制取CO2,应该选用的发生装置是
A
A
,他不选择加热固体碳酸氢铵制取CO2的理由是生成的二氧化碳中混有氨气
生成的二氧化碳中混有氨气
.③A装置中试管口略向下倾斜的原因是
防止水蒸气倒流入试管内使试管炸裂
防止水蒸气倒流入试管内使试管炸裂
.(3)已知二氧化碳能与水反应生成酸.某同学设计了以下实验,验证了这一结论.
实验1:取4朵用石蕊溶液染成紫色的干燥的纸花.往第一朵纸花上喷上稀醋酸,小花变红色.
实验2:往第二朵纸花上喷上水,纸花不变色.
实验3:
实验4:往第四朵纸花上喷水后,再放入盛有CO2的集气瓶中,纸花变红色.
回答下列问题:
①实验2的目的是
证明水不能使紫色石蕊试液变红
证明水不能使紫色石蕊试液变红
;②请补充实验3:
将第二朵纸花伸入盛有二氧化碳的集气瓶中
将第二朵纸花伸入盛有二氧化碳的集气瓶中
;③二氧化碳与水反应的化学方程式为
CO2+H2O=H2CO3
CO2+H2O=H2CO3
.(4)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入50g稀盐酸(盐酸没有消耗完).反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量).试计算石灰石中杂质的质量分数.
分析:(1)根据元素周期表表示的意义考虑;(2)①根据气体发生装置和收集装置的选取方法考虑;②根据反应条件和生成物考虑;③根据药品中含有潮气导致的后果考虑;(3)①根据实验现象考虑证明的问题;②通过对比试验缺少的方面考虑③根据方程式的写法考虑;(4)根据药品质量的减少量是生成二氧化碳的质量,再根据二氧化碳的质量算出碳酸钙的质量,再用混合物质量减去碳酸钙的质量就是杂质质量.
解答:解:(1)碳属于非金属元素,原子序数是6,等于核内质子数也是6,正下方是相对原子质量,相对原子质量单位是1省略不写,不是g故答案D不对,所以选D答案;
(2)①反应物是固体和液体不需要加热,由于二氧化碳能溶于水,不能用排水法收集,密度比空气大只能用向上排空气法收集;
②由于反应条件是加热,用到酒精灯,所以发生装置是A,第二种方法的生成物中有两种气体,制得的气体不纯;
③药品中含有潮气加热后变为水蒸气,如果试管口向上倾斜,水蒸气在试管口会冷凝成水滴倒流入试管底部,使试管炸裂;
(3)①往第二朵纸花上喷上水,纸花不变色证明水不能使紫色石蕊试液变红;
②通过设计的对比实验可知缺少证明二氧化碳是否能使紫色石蕊试液变色;
③反应物是二氧化碳和水,生成物是碳酸,已经平了;
(4)根据药品质量的减少量是生成二氧化碳的质量,所以生成二氧化碳:12.5g+50g-58.1g=4.4g,设要生成4.4g二氧化碳需碳酸钙质量为X则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 4.4g
根据:
=
解得X=10g,所以含杂质12.5g-10g=2.5g,所以杂质质量分数:
×100%=25%.
故答案为:(1)D;(2)①B;C;②A;生成的二氧化碳中混有氨气③防止水蒸气倒流入试管内使试管炸裂(3)①证明水不能使紫色石蕊试液变红;②将第二朵纸花伸入盛有二氧化碳的集气瓶中③CO2+H2O=H2CO3;(4)25%
(2)①反应物是固体和液体不需要加热,由于二氧化碳能溶于水,不能用排水法收集,密度比空气大只能用向上排空气法收集;
②由于反应条件是加热,用到酒精灯,所以发生装置是A,第二种方法的生成物中有两种气体,制得的气体不纯;
③药品中含有潮气加热后变为水蒸气,如果试管口向上倾斜,水蒸气在试管口会冷凝成水滴倒流入试管底部,使试管炸裂;
(3)①往第二朵纸花上喷上水,纸花不变色证明水不能使紫色石蕊试液变红;
②通过设计的对比实验可知缺少证明二氧化碳是否能使紫色石蕊试液变色;
③反应物是二氧化碳和水,生成物是碳酸,已经平了;
(4)根据药品质量的减少量是生成二氧化碳的质量,所以生成二氧化碳:12.5g+50g-58.1g=4.4g,设要生成4.4g二氧化碳需碳酸钙质量为X则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 4.4g
根据:
| 100 |
| 44 |
| X |
| 4.4g |
| 2.5g |
| 10g |
故答案为:(1)D;(2)①B;C;②A;生成的二氧化碳中混有氨气③防止水蒸气倒流入试管内使试管炸裂(3)①证明水不能使紫色石蕊试液变红;②将第二朵纸花伸入盛有二氧化碳的集气瓶中③CO2+H2O=H2CO3;(4)25%
点评:通过回答本题要知道反应物的状态是固体和液体,不需要加热,如果固体与固体反应制取气体需要加热,收集方法的选择是根据:难溶于水或不易溶于水用排水法收集,密度比空气大用向上排空气法收集,密度比空气小用向下排空气法收集;制取二氧化碳用盐酸和碳酸钙是固体和液体不需要加热,反应装置选B,由于二氧化碳密度比空气大,用向上排空气法收集,能溶于水不能用排水法收集.知道了对比试验的设计方法,根据现象说出结论方法.

练习册系列答案
相关题目
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容. D.碳的相对原子质量为12.01
D.碳的相对原子质量为12.01
 碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容.