题目内容
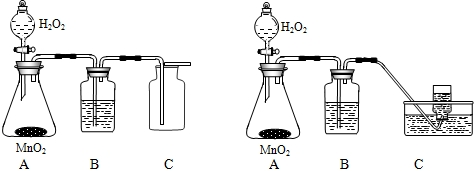
化学实验室常用3%的H2O2溶液来制取氧气,小亮和小君欲用3%的H2O2溶液来制取干燥的氧气,小亮使用的是左下装置图,小君使用的是右下装置图.试回答:

(1)小君同学使用的装置是不合理的,原因是
(2)两装置的B仪器中应盛放的物质是
(3)从严格意义上说,小亮使用的收集装置也不尽合理,理由是
(4)当H2O2完全分解时,液体中氢元素的质量分数会增加

(1)小君同学使用的装置是不合理的,原因是
制得的气体没有干燥
制得的气体没有干燥
;(2)两装置的B仪器中应盛放的物质是
浓硫酸
浓硫酸
;(3)从严格意义上说,小亮使用的收集装置也不尽合理,理由是
空气中含有水蒸气
空气中含有水蒸气
.(4)当H2O2完全分解时,液体中氢元素的质量分数会增加
0.1
0.1
%(保留到小数点后1位).分析:(1)结合题意分析,制取干燥的氧气通常选用排空气法;
(2)浓硫酸具有吸水性,是常用的液体干燥剂;
(3)从实验的目的结合实验装置进行分析;
(4)双氧水溶液的溶质和溶剂里都含有氧元素,先假设溶液质量为100g,分别计算出双氧水和水中H元素的质量分数,再根据氢元素的质量分数=
×100%计算出原溶液中氢元素的质量分数;根据双氧水分解的化学方程式可知,当双氧水完全分解时,气体逸出,溶液质量减少,而液体中氢元素的质量不变,原溶液的质量减去生成气体的质量就是反应后溶液质量,再根据反应后氢元素的质量分数=
×100%,两个质量分数之差就是液体中氢元素的质量分数增加的数值.
(2)浓硫酸具有吸水性,是常用的液体干燥剂;
(3)从实验的目的结合实验装置进行分析;
(4)双氧水溶液的溶质和溶剂里都含有氧元素,先假设溶液质量为100g,分别计算出双氧水和水中H元素的质量分数,再根据氢元素的质量分数=
| 过氧化氢和水中氢元素的质量之和 |
| 溶液的质量 |
| 氢元素的质量 |
| 溶液的质量 |
解答:解:(1)要得到干燥的氧气,不能用排水法,这样制得的气体中含有水分;
(2)氧气与浓硫酸不反应,可以使用浓硫酸做干燥剂;
(3)空气中也含有水蒸气,故小亮使用的装置所收集的氧气也含有少量水蒸气;
(4)设双氧水溶液的总质量为100g,则双氧水为3g,水为97g,
过氧化氢中氢元素的质量分数是:
×100%=5.9%
水中氢元素的质量分数是:
×100%=11.1%
∴氢元素的质量分数为:
×100%≈10.98%≈11.0%;
设:生成氧气的质量为x,
2H2O2
2H2O+O2↑
68 32
3g x
=
x≈1.41g
由于氢元素的质量保持不变,所以仍为100g×10.98%=10.98g
∴反应后液体中氢元素的质量分数是:
×100%≈11.1%,
∴液体中的氢元素的质量分数增加11.1%-11.0%=0.1%.
故答案为:
(1)制得的气体不干燥;
(2)浓硫酸;
(3)空气中含有水蒸气;
(4)0.1%.
(2)氧气与浓硫酸不反应,可以使用浓硫酸做干燥剂;
(3)空气中也含有水蒸气,故小亮使用的装置所收集的氧气也含有少量水蒸气;
(4)设双氧水溶液的总质量为100g,则双氧水为3g,水为97g,
过氧化氢中氢元素的质量分数是:
| 2 |
| 34 |
水中氢元素的质量分数是:
| 2 |
| 18 |
∴氢元素的质量分数为:
| 3g×5.9%+97g×11.1% |
| 100g |
设:生成氧气的质量为x,
2H2O2
| ||
68 32
3g x
| 68 |
| 32 |
| 3g |
| x |
x≈1.41g
由于氢元素的质量保持不变,所以仍为100g×10.98%=10.98g
∴反应后液体中氢元素的质量分数是:
| 10.98g |
| 100g-1.41g |
∴液体中的氢元素的质量分数增加11.1%-11.0%=0.1%.
故答案为:
(1)制得的气体不干燥;
(2)浓硫酸;
(3)空气中含有水蒸气;
(4)0.1%.
点评:本题能较好的考查学生学生运用化学式和化学方程式以及质量分数公式进行计算的能力,并考查了依据题意对于装置的分析评价,气体的干燥等知识.

练习册系列答案
相关题目