题目内容
化学实验室常用3%的H2O2溶液来制取氧气,小亮和小君欲用3%的H2O2溶液来制取干燥的氧气,小亮使用的是左下装置图,小君使用的是右下装置图.试回答: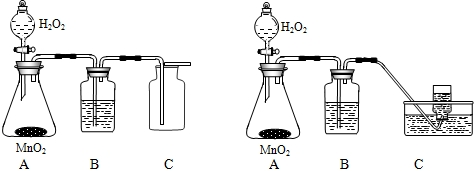
(1)小君同学使用的装置是不合理的,原因是
(2)两装置的B仪器中应盛放的物质是
(3)从严格意义上说,小亮使用的收集装置也不尽合理,理由是
(4)3%的H2O2溶液中,氢元素的质量分数为
分析:(1)收集气体时根据气体的溶解性和密度选择收集方法;(2)浓硫酸和氢氧化钠固体都具有吸水性,可以用作干燥剂;(3)从实验的目的进行分析;(4)因为双氧水溶液的溶质和溶剂里都含有氧元素,故需先假设溶液质量为100g,分别计算出H2O2和H2O中H元素的质量分数,再根据氢元素的质量分数=
×100%计算即可;根据双氧水分解的化学方程式可知,当双氧水完全分解时,气体逸出,溶液质量减少,故这时液体中氢元素的质量不变,原溶液的质量减去生成气体的质量就是反应后溶液质量,再根据反应后氢元素的质量分数=
×100%,两个质量分数之差就是液体中氢元素的质量分数增加的数值.
| 过氧化氢和水中H元素的质量之和 |
| 溶液质量的总质量 |
| 氢元素的质量 |
| 溶液的质量 |
解答:解:(1)因为要得到干燥的氢气,就不能用排水法;(2)氧气与浓硫酸不反应,可以使用浓硫酸做干燥剂;(3)因空气中含有水蒸气,故小亮使用的装置收集的氧气也不是太干燥;(4)根据双氧水的化学式H2O2可得H元素的质量分数为:
×100%≈5.9%,H2O中H元素的质量分数为
×100%≈11.1%,
解:设总质量为100g,则双氧水(H2O2)为3g,水(H2O)为97g,
∴氢元素的质量分数为:
×100%≈10.98%≈11.0%;
②设:生成O2质量为x,
2H2O2═2H2O+O2↑
68 32
3 x
=
解之得:x≈1.41g
×100%≈11.1%,
液体中的氢元素的质量分数增加11.1%-11.0%=0.1%.
故答案为:(1)制得的气体不干燥;(2)浓硫酸;(3)空气中含有水蒸气;(4)11.0%; 0.1%.
| 2 |
| 34 |
| 2 |
| 18 |
解:设总质量为100g,则双氧水(H2O2)为3g,水(H2O)为97g,
∴氢元素的质量分数为:
| 3×5.9%+97×11.1% |
| 100 |
②设:生成O2质量为x,
2H2O2═2H2O+O2↑
68 32
3 x
| 68 |
| 32 |
| 3 |
| x |
解之得:x≈1.41g
| 10.98 |
| 100-1.41 |
液体中的氢元素的质量分数增加11.1%-11.0%=0.1%.
故答案为:(1)制得的气体不干燥;(2)浓硫酸;(3)空气中含有水蒸气;(4)11.0%; 0.1%.
点评:本题从实验装置,制取干燥气体的顺序,如何收集气体等方面考查了氧气的实验室制法,同时考察了学生运用化学式和化学方程式以及质量分数公式进行计算的能力.

练习册系列答案
相关题目