题目内容
【题目】化学是以实验为基础的科学,实验是科学探究的重要手段。
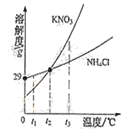
(1)数字化装备正逐步进入校园,利用数字传感器可以测得酸与碱反应过程中溶液pH变化的图象。如图是盐酸与氢氧化钠溶液反应过程中的pH变化的图象。
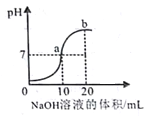
①反应的化学方程式为_________________________。
②当溶液呈中性时,所消耗氢氧化钠溶液的体积是___________;
③图中b点所示溶液中,含有的溶质是____________。
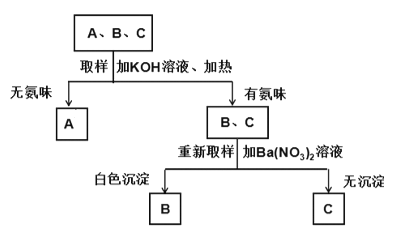
(2)在“创新实验装置”的竞赛中,某化学兴趣小组设计了如图所示的装置(夹持仪器已略去),引起同学们的兴趣。
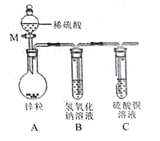
①请写出仪器M的名称_________,仪器M的优点_____________;
②打开M的活塞后,装置A中发生的反应方程式为_____________;
③打开M的活塞后,装置C中的现象为_____________________。
(3)实验室里,现有一瓶未知浓度的过氧化氢溶液,取该溶液34g于烧杯中,加入一定量的二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是34.4g,将杯内剩余物质过滤、洗涤、干燥后得滤渣2g。计算:瓶内过氧化氢溶液中溶质的质量为____________________。
【答案】 HCl+NaOH==NaCl+H2O 10 NaOH和NaCl 分液漏斗 通过控制液体的滴加速率和用量,能够控制反应发生的速率和产气量 Zn+H2SO4=== ZnSO4+ H2↑ 装置C中有溶液流入,生成蓝色沉淀 3.4g
【解析】(1) ①根据氢氧化与盐酸反应生成氯化钠和水解答;②根据图像解答;③根据溶液呈碱性分析解答;(2) ①根据常见仪器及其优点分析解答;②根据锌与硫酸反应生成硫酸锌和氢气解答;③根据锌与稀硫酸反应生成的氢气会增大装置B中的压强,将氢氧化钠排入装置C中,氢氧化钠和硫酸铜会生成氢氧化铜沉淀进行分析;(3)根据生成的氧气的质量结合反应的化学方程式求出瓶内过氧化氢溶液中溶质的质量。(1) ①氢氧化与盐酸反应生成氯化钠和水,反应的化学方程式为HCl+NaOH=NaCl+H2O;②由图可知,当溶液呈中性时,此时溶液pH=7,所消耗氢氧化钠溶液的体积是10mL;③图中b点所示溶液显碱性,含有的溶质有过量的NaOH及NaOH与HCl反应生成的NaCl;(2) ①仪器M的名称是分液漏斗,其优点是通过控制液体的滴加速率和用量,能够控制反应发生的速率和产气量;②锌与硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4= ZnSO4+ H2↑;③打开M的活塞后,装置C中的现象为装置C中有溶液流入,生成蓝色沉淀;(3)生成氧气的质量=34g+2g-34.4g=1.6g
设瓶内过氧化氢溶液中溶质的质量为x。
2H2O2MnO22H2O+O2↑
68 32
x 1.6g
![]()
x=3.4g
答:瓶内过氧化氢溶液中溶质的质量为3.4g。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】安徽某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。)有关实验数据如下表:
反应前 | 反应后 | ||
实验 数据 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
180 g | 12g | 187.6g | |
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为___________g。
(2)求该石灰石中碳酸钙的质量分数_______________。