题目内容
有一种石灰石样品的成分是CaCO3和SiO2(已知SiO2既不溶于水也不与盐酸反应)。现取8g石灰石样品与足量的50g稀盐酸完全反应后,称得容器内的物质总质量为55.36g。
试回答下列问题:
(1)反应后容器内的物质有 。
(2)反应产生二氧化碳的质量为 。
(3)该石灰石样品中碳酸钙的质量分数是多少?
试回答下列问题:
(1)反应后容器内的物质有 。
(2)反应产生二氧化碳的质量为 。
(3)该石灰石样品中碳酸钙的质量分数是多少?
(1)SiO2、CaCl2、HCl、H2O(写对1-2个给1分,写对3-4个给2分,有错不给分)
(2)2.64g
(3) 75%
(2)2.64g
(3) 75%
试题分析:
由题意可得:CaCO3+2HCl=CaCl2+H2O+CO2↑,故有:
(1)反应后容器内的物质有SiO2、CaCl2、HCl、H2O。
(2)反应产生二氧化碳的质量为58g-55.36g=2.64g。
(3)解:设石灰石样品中碳酸钙的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.64g
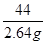
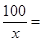

x=6g
石灰石样品中碳酸钙的质量分数为:
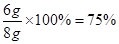
答:石灰石样品中碳酸钙的质量分数为75% 。
点评:化学反应遵守质量守恒定律,参加反应的各物质的质量之和等于反应后生成的各物质的质量之和,据此可以解答(1)(2)小题,在解答(3)小题时,要注意解题的步骤:设、写、找、列、解、答。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2H2↑+O2↑),常在水中加入硫酸来增强溶液的导电性,但硫酸本身不发生化学反应。现将溶质的质量分数为10%的稀硫酸90.0 g通电一段时间后停止反应,测得生成氧气为8.0 g,计算:
2H2↑+O2↑),常在水中加入硫酸来增强溶液的导电性,但硫酸本身不发生化学反应。现将溶质的质量分数为10%的稀硫酸90.0 g通电一段时间后停止反应,测得生成氧气为8.0 g,计算: 
 Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )
Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )