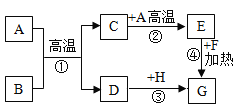
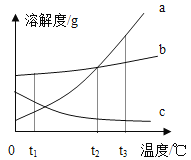
题目内容
【题目】为测定某黄铜(![]() 合金)样品中锌的质量分数,某学习小组进行了如下实验:取
合金)样品中锌的质量分数,某学习小组进行了如下实验:取![]() 黄铜样品,将其放在烧杯中,然后把
黄铜样品,将其放在烧杯中,然后把![]() 稀硫酸分四次加入到烧杯中,其反应的情况如下所示:
稀硫酸分四次加入到烧杯中,其反应的情况如下所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/ | 10 | 10 | 10 | 10 |
剩余黄铜样品的质量/ | 8.7 | 7.4 |
| 6.6 |
(1)表中的![]() 的值为_____。
的值为_____。
(2)此黄铜样品中锌的质量分数为_____。
(3)所用稀硫酸溶质的质量分数是多少_____(写出解题过程)。
【答案】6.6 34% 19.6%
【解析】
(1)根据前两次每次消耗固体的质量为1.3g,第四次加入的硫酸后,两次固体减少了0.8g,所以第三次加入稀硫酸后锌完全反应,所以第四次加入稀硫酸后剩余的固体质量不变,所以M=6.6;
(2)前两次每次消耗固体的质量为1.3g,第三次加入的硫酸后,固体减少了0.8g,所以第三次加入稀硫酸后锌完全反应,所以参加反应的锌的质量是:3.4g,黄铜样品中锌的质量分数为:![]() ;
;
(3)设参加反应的硫酸的质量为x,
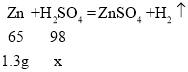
![]()
![]() ,
,
所用稀硫酸的质量分数为![]() ;
;
答:所用稀硫酸溶质的质量分数为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】2019年山西省实验考试新增了《用盐酸除铁锈》的实验试题,同学们在练习实验操作时,发现实验题中的要求有“先将生锈铁钉放在试管中,加入稀盐酸,加热试管”。其中“加热”的目的是________,之后观察到铁锈消失,溶液变为黄色。同学们将实验后的黄色废液倒入废液缸,化学研究小组同学对该废液的成分产生了兴趣并进行探究。
(查阅资料)
①![]()
②![]() 的检验:加入铁氰化钾(化学式为
的检验:加入铁氰化钾(化学式为![]() )溶液,生成铁氰化亚铁蓝色沉淀。
)溶液,生成铁氰化亚铁蓝色沉淀。
(提出问题)
废液中含有哪些离子?
(猜想假设)
同学们经过分析认为,废液中一定有的离子是![]() 、
、![]() ,对于可能存在的其中一种离子,兴趣小组的同学们首先进行了如下实验:
,对于可能存在的其中一种离子,兴趣小组的同学们首先进行了如下实验:
(实验操作一)
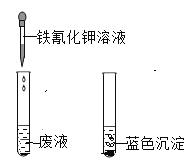
结论:________一定存在。
接下来同学们对这种离子的来源展开了讨论,绝大多数同学认为是Fe和![]() 发生反应生成,也有同学对此提出质疑,他们质疑的理由是________(用化学方程式表示)。
发生反应生成,也有同学对此提出质疑,他们质疑的理由是________(用化学方程式表示)。
(实验操作二)
经过分析,同学们认为还有另一种离子也可能存在,为了证明这种离子是否存在,请你帮助他们一起进行实验:
实验步骤 | 实验现象 | 结论 | |
方案一 | 取少量废液于试管中,加入紫色石蕊溶液 | ______________________ | 可能存在的离子一定存在 |
方案二 | ___________________ | ______________________ |
通过以上探究活动得知,这种黄色废液中一定含有的物质是________(写化学式)。
(反思评价)
实验后的废液直接倾倒,会造成土壤、水源污染,要做到绿色排放,需在废液中加入适量的________。