题目内容
【题目】万二中化学兴趣小组进行空气中氧气含量的测定实验,用图甲装置测出氧气的体积分数小于五分之一。
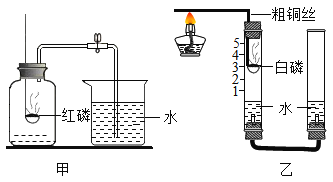
《提出问题》造成误差的原因是什么?如何改进?
《猜想与假设》A同学:可能是导管中残留了一部分水;B同学:可能氧气没有耗尽
(1)你还能做出的猜想是____
经过交流,小组同学对装置进行图乙的改进
(2)图乙与图甲相比,其优点是___
(3)图乙中能得出氧气约占空气体积五分之一的结论的现象是___
(4)写出乙装置中发生反应的符号表达式___
(5)小组成员提出将红磷换成镁条,测定结果最后大于五分之一,原因是___
【答案】装置气密性不好或没有冷却到室温就打开止水夹 生成的五氧化二磷不会逸散到空气中,不污染空气;在封闭空间内测得数据更准确,实验误差小;节约药品等 左边的水柱上升至刻度1处 P + O2![]() P2O5 镁条燃烧消耗了一部分空气中的氮气
P2O5 镁条燃烧消耗了一部分空气中的氮气
【解析】
(1)你还能做出的猜想是:装置气密性不好或没有冷却到室温就打开止水夹;
(2)图乙与图甲相比,其优点是:生成的五氧化二磷不会逸散到空气中,不污染空气;在封闭空间内测得数据更准确,实验误差小;节约药品等;
(3)图乙中能得出氧气约占空气体积五分之一的结论的现象是:左边的水柱上升至刻度1处;
(4)写出乙装置中白磷在氧气中燃烧反应的符号表达式:P + O2![]() P2O5;
P2O5;
(5)小组成员提出将红磷换成镁条,测定结果最后大于五分之一,原因是:镁条不仅能与空气中的氧气发生反应,还能与氮气反应,镁条燃烧消耗了一部分空气中的氮气。

【题目】某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
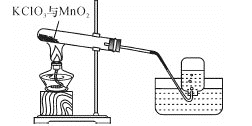
(1)共制得氧气_________g。
(2)计算所得氯化钾溶液的溶质质量分数_________。
【题目】通过联想提出问题是探究的源泉,某合作学习小组开展了如下探究,请你协助他们完成:
(提出问题)温度越高,分子运动越快;温度越高,化学反应也越快吗?
(实验探究)为了探究温度对H2O2分解反应速率的影响,某实验小组使用如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分数据如表所示:
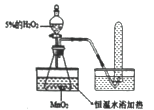
实验1 | 实验2 | |
MnO2的质量/g | 0.5 | 0.5 |
5%的H2O2的体积/mL | 40 | X |
恒温水浴加热/℃ | 40 | 80 |
收集一试管氧气所需要时间/秒 | 36 | 23 |
(1)在这两个实验中,收集氧气采用的方法是_________。
(2)实验2中X=_______。
(3)上述实验中所发生的文字表达式为______________,属于________反应。
(实验结论)通过两次实验的实验记录,你可以得出的实验结论是______________;
(实验拓展)请根据所学再举出一例与温度有关的实验结论:温度越高,__________。