题目内容
【题目】将等质量的镁、铁、锌,分别放入三份溶质质量分数相同的稀盐酸中,反应生成的H2质量与反应时间的关系如图所示.根据图中的信息,作出的判断不正确的是( )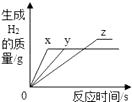
A.图线x表示镁的反应情况
B.铁消耗的稀盐酸质量最大
C.镁、锌一定过量,铁可能反应完
D.镁一定过量,锌、铁可能反应完
【答案】C
【解析】A、由于盐酸的溶质质量分数相同,而图中X反应速度最快,说明X是三种金属中活动性最强的镁;A不符合题意;
B、图中铁生成氢气最多,根据反应前后元素质量不变,而盐酸的溶质质量分数相同,故可判断铁消耗盐酸质量最大;B不符合题意;
C、图中镁、锌产生氢气质量相等,说明镁没有完全反应,但不能确定锌也没有完全反应;C符合题意;
D、从图中看到镁和锌反应生成的氢气一样多,则消耗的稀盐酸一样多,那么镁一定过量,锌可能过量或反应完,D不符合题意.
故答案为:C.利用关系图,在金属未停止反应前的任意相同时间内,放出氢气多的反应速度快金属活动性强.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案
相关题目