��Ŀ����
ʵ������һƿ���ܲ������Լ�����ͼ�������ȱ�ı�ǩ��ֻʣ�¡�Na���͡�10%����������֪������ɫҺ�壬�dz��л�ѧ���õ��Լ���

��1�����������ǩ������жϣ���ƿ�Լ���������
A���� B���� C����
��2�� ��֪ ���л�ѧ�����ĺ��ƻ�������NaCl��NaOH��Na2CO3��NaHCO3��
��Na2CO3��NaHCO3��Һ���ʼ��ԡ�
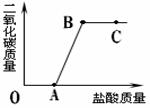
�����£�20�棩ʱ���������ʵ��ܽ�ȵ���������ͼ��
�����Լ�ƿ��ע��������������10%���ұ��е��ܽ�ȵ������жϣ���ƿ�Լ��������� ��
��3�� ��pH��ֽ�ϲ�ø���Һ��pH��7����ƿ�Լ��������� ��
��4�� Ϊ��ȷ������Һ��������Һ���ֽ������½�һ����ʵ�飺
��5��������ѡ���루4���в�ͬ���Լ�ȷ������Һ����ѡ����Լ��� ��Ҫ�����ͬ����
��6�� Ϊ��̽��һƿ�Ȼ�����Һ������������ȡ����Һ50g������50g̼�����Һ��ǡ����ȫ��
Ӧ��������Һ����95g��������Ȼ�����Һ������������

��1�����������ǩ������жϣ���ƿ�Լ���������
A���� B���� C����
��2�� ��֪ ���л�ѧ�����ĺ��ƻ�������NaCl��NaOH��Na2CO3��NaHCO3��
��Na2CO3��NaHCO3��Һ���ʼ��ԡ�
�����£�20�棩ʱ���������ʵ��ܽ�ȵ���������ͼ��
| ���� | NaCl | NaOH | Na2CO3 | NaHCO3 |
| �ܽ��g | 36 | 109 | 215 | 9��6 |
�����Լ�ƿ��ע��������������10%���ұ��е��ܽ�ȵ������жϣ���ƿ�Լ��������� ��
��3�� ��pH��ֽ�ϲ�ø���Һ��pH��7����ƿ�Լ��������� ��
��4�� Ϊ��ȷ������Һ��������Һ���ֽ������½�һ����ʵ�飺
| �������� | ʵ������ | ���ۼ���ѧ����ʽ |
| ȡ�����Թ��У��μ� | �������������� | ����Һ�� ����Ӧ�Ļ�ѧ����ʽ |
��6�� Ϊ��̽��һƿ�Ȼ�����Һ������������ȡ����Һ50g������50g̼�����Һ��ǡ����ȫ��
Ӧ��������Һ����95g��������Ȼ�����Һ������������
��1�� A ��2�� NaHCO3��3�� NaCl
��4�� ϡ���ᣨ��ϡ���ᣩ̼������Һ Na2CO3+2HCl�T2NaCl+H2O+CO2��
��5�� CaCl2 [ ��BaCl2��Ca(NO3)2��Ba(NO3)2�� Ca(OH)2��Ba(OH)2�� ]
��6�� 11��1%��
��4�� ϡ���ᣨ��ϡ���ᣩ̼������Һ Na2CO3+2HCl�T2NaCl+H2O+CO2��
��5�� CaCl2 [ ��BaCl2��Ca(NO3)2��Ba(NO3)2�� Ca(OH)2��Ba(OH)2�� ]
��6�� 11��1%��
������������������ǩ������жϣ������к�����Ԫ�أ��ǽ���Ԫ�أ���������ε���ɣ���ƿ�Լ����������ᣬ��������ʱ�����ʵ��ܽ�ȣ������̼�����Ƶı�����Һ����������������Ҳ��������10%��������ƿҩƷ����ʹ̼�����ƣ���pH��ֽ�ϲ�ø���Һ��pH��7��˵������Һ�Լ��ԣ����Ȼ�����Һ�����ԣ����Բ��������Ȼ��ƣ����Ը�ƿ��Һ�������������ƻ���̼���ƣ���֤������ȡ������Ʒ���Թ��еμ�ϡ���ᣬ�������������ݣ�����Һ��̼������Һ����Ӧ�ķ���ʽΪNa2CO3+2HCl�T2NaCl+H2O+CO2����������ѡ���루4���в�ͬ���Լ�ȷ������Һ��ֻҪ�ܺ�̼���Ʒ�����Ӧ�ģ����磺CaCl2 ��BaCl2��Ca(NO3)2��Ba(NO3)2�� Ca(OH)2��Ba(OH)2�� �����ԣ�����ʱ������ɫ���������һ���Ǹ��ݻ�ѧ����ʽ���м��㣬
�⣺��ԭ��Һ��CaCl2������Ϊx
CaCl2+K2CO3�TCaCO3��+2KCl
111 100
x ��50g+50g��95g��
111/100==x/(50g+50g---95g) x ==5��55g
����Һ����CaCl2����������Ϊ��
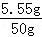 ��100%=11��1%
��100%=11��1% ������CaCl2��Һ����������11��1%��

��ϰ��ϵ�д�
�����Ŀ