题目内容
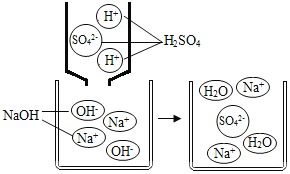
【题目】中和反应是一类重要的化学反应。某同学利用图1装置研究稀硫酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关的变化情况,得到图2和图3。
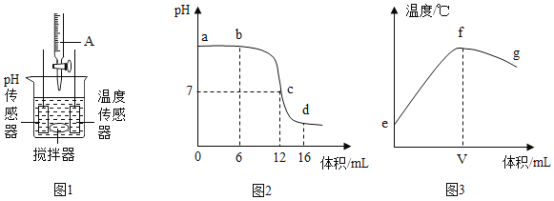
(1)烧杯中发生反应的化学方程式为______。
(2)仪器A中溶液的溶质是_____(填化学式)。
(3)图3中V的数值最接近_____(填“6”、“12”或“16”)。
(4)下列说法错误的是_____。
A.图2中b点所示溶液中的溶质是Na2SO4和NaOH
B.图2中d点所示溶液中所含微粒有Na+、SO42-、H+、H2O
C.图2中c→d所示溶液中Na2SO4的质量不断增加
D.图3中e→f变化趋势可说明该反应是放热反应
(5)本实验中需要准备溶质质量分数为9.8%的稀硫酸250g,若用98%的浓硫酸来配制,需要浓硫酸____克,需加水_____mL(水的密度为1g/mL)。
【答案】2NaOH+H2SO4═Na2SO4+2H2O H2SO4 12 C 25 225
【解析】
(1)稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,发生反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O。
(2)由图象可知,pH值是开始时大于7逐渐减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀硫酸滴加到氢氧化钠溶液中,仪器A中溶液的溶质是硫酸,其化学式为H2SO4。
(3)图3中V时,放出的热量最多,溶液恰好完全反应,pH=7,结合图2可知,图3中V的数值最接近12。
(4)A、b点溶液的pH大于7,溶液显碱性,b点所示溶液中的溶质是反应生成的Na2SO4和反应物NaOH,不符合题意;
B、d点溶液的pH小于7,溶液显酸性,d点所示溶液中溶质是硫酸钠和硫酸,所含微粒有Na+、SO42-、H+、H2O,不符合题意;
C、c→d,是完全反应后继续向溶液中滴加稀硫酸,c→d所示溶液中Na2SO4的质量不变,符合题意;
D、e→f,温度逐渐升高,该变化趋势可说明该反应是放热反应,不符合题意。故选C。
(5)设需要浓硫酸的质量为![]() ,根据溶液稀释前后溶质的质量不变,则250g×9.8%=
,根据溶液稀释前后溶质的质量不变,则250g×9.8%=![]() ×98%,
×98%,![]() =25g,需加水的质量为250g-25g=225g,水的密度为1g/mL),水的体积=
=25g,需加水的质量为250g-25g=225g,水的密度为1g/mL),水的体积=![]() =225mL。
=225mL。