题目内容
【题目】多角度认识溶液,有助于我们更好地了解其在生产生活中的重要作用。
(1)溶液的形成
①将适量调味品加入水中,充分搅拌后不能形成溶液的是(填标号)。
A.食盐 B.蔗糖 C.花生油 D.味精
②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水。写出生石灰与水
反应的化学方程式。
(2)溶液的性质
① 关于溶液的说法正确的有(填标号)。
A.溶液是纯净物 B.溶液是均一、稳定的
C.溶液的酸碱度可用石蕊溶液测定 D.饱和溶液不一定是浓溶液
②实验测得下列四种溶液的pH如图所示,其中溶液呈碱性的是
(3)物质的溶解性
①下图是X、Y、Z三种物质的溶解度曲线,
a.t1℃ 时溶解等质量的X、Y、Z三种物质,所消耗的水最多的是 ;
b.将t2℃ 时 X、Y、Z三种物质的饱和溶液升温到t3℃,所得溶液仍是饱和溶液的是
②常温下,将某固态物质A溶于水,形成饱和溶液I(如下图),进行以下实验。回答下列问题:
a.物质A的溶解度随温度的升高而(填“增大”或“减小”)。
b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈紫红色。据此现象说明在某物质的饱和溶液中“能”或“不能”)继续溶解其他物质。
③常温时,某物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示。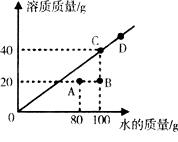
a.常温时,该物质的溶解度是。
b.A点时,该溶液的溶质质量分数为。
C.图中A、B、C、D四个点表示的溶液中溶质质量分数从大到小的关系是。
【答案】
(1)C,CaO + H2O → Ca(OH)2
(2)B,D
(3)碳酸钠,X,Z,减小,能,40g,20%(1/5),C = D > A > B
【解析】(1)溶液的形成①将适量调味品加入水中,充分搅拌后不能形成溶液的是C.花生油 ,可形成乳浊液。A.食盐,B.蔗糖,D.味精,均可形成溶液。②将生石灰和足量的水充分搅拌后静置,取上层清液即为澄清石灰水。反应的化学方程式是 CaO + H2O= Ca(OH)2 ;
(2)溶液的性质。① 关于溶液的说法正确的有:B.溶液是均一、稳定的。这是溶液的两大特征。故B正确。D.饱和溶液不一定是浓溶液。因溶液是否饱和与溶液浓稀没有必然联系。故D正确。A.溶液是混合物,不是纯净物。故A错误。C.溶液的酸碱度不可用石蕊溶液测定,可用pH计测量。②实验测得下列四种溶液,其中溶液呈碱性的是碳酸钠。pH>7,溶液呈碱性;pH<7,溶液呈酸性;pH=7,溶液呈中性;
(3)物质的溶解性:①根据溶解度曲线图,a. t1℃ 时溶解等质量的X、Y、Z三种物质,所消耗的水最多的是X。b. 将t2℃ 时 X、Y、Z三种物质的饱和溶液升温到t3℃,所得溶液仍是饱和溶液的是Z。② 常温下,将某固态物质A溶于水,形成饱和溶液I。a.物质A的溶解度随温度的升高而减小。b.往溶液Ⅱ中加入少量高锰酸钾完全溶解,溶液呈紫红色。据此现象说明在某物质的饱和溶液中能继续溶解其他物质。③常温时,某物质在不同质量的水中溶解达到饱和状态,根据题图知,a.常温时,该物质的溶解度是40g。b.A点时,该溶液的溶质质量分数为: ![]() ×100%=20%。C.图中A、B、C、D四个点表示的溶液中溶质质量分数从大到小的关系是C = D > A > B.
×100%=20%。C.图中A、B、C、D四个点表示的溶液中溶质质量分数从大到小的关系是C = D > A > B.
所以答案是:(1)C;CaO+H2O═Ca(OH)2;(2)B ;D;(3)碳酸钠;X,Z;减小;能;.40g;20%;C=D>A>B.
【考点精析】根据题目的已知条件,利用饱和溶液和不饱和溶液和固体溶解度曲线及其作用的相关知识可以得到问题的答案,需要掌握饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案