题目内容
【题目】甲、乙两同学在学完酸的化学性质后,做了如下实验
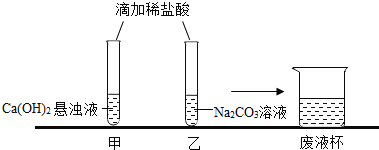
【观察与讨论】甲同学在做实验时观察到的明显现象是悬浊液变澄清,再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性);
【观察与讨论】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl =NaCl+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl =NaCl+ H2O +CO2↑。所以甲同学认为,乙同学实验时还应_____________,才能观察到有气泡产生;
【观察与讨论】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】猜想:废液中含有NaCl、CaCl2两种溶质;
猜想:废液中含有_____、_____、_____(写化学式)三种溶质;
猜想:废液中含有_____、_____、_____(写化学式)三种溶质;
【活动与探究】甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生;
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色;
【结论与反思】(1)猜想2正确;
(2)要得到相同的结论,还可采用很多种方法,如加入黑色固体粉末,可观察到固体溶解,溶液呈蓝色,该反应的化学方程式为_____;
【表达与交流】甲、乙同学确认了最终废液中溶质的成分,若直接排放,可能腐蚀下水道或水质酸化,你认为处理该废液的方法是_____。
【答案】 继续加入稀盐酸 ![]()
![]()
![]()
![]()
![]()
![]() CuO + 2HCl = CuCl2 + H2O 将废液中和至中性再排放
CuO + 2HCl = CuCl2 + H2O 将废液中和至中性再排放
【解析】【观察与讨论】氢氧化钙的悬浊液中滴加稀盐酸,能发生中和反应,所以会观察到悬浊液变澄清;②通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。所以要观察到有气泡冒出,需要继续滴加稀盐酸;【猜想与假设】甲试管为新盐酸与氢氧化钙反应,所以溶质中一定含有溶质CaCl2,可能有HCl;乙试管为碳酸钠和稀盐酸反应,因是观察到气泡后的废液,所以一定没有碳酸钠,所以溶质中一定含有溶质NaCl,可能有碳酸氢钠 ;猜想含有两种溶质,则一定含有NaCl、CaCl2 。盐酸与碳酸氢钠不共存,所以含有三种溶质时,则溶质为NaCl、CaCl2、HCl或NaCl、CaCl2、NaHCO3。甲同学实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生,说明无碳酸氢钠;乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色,说明溶液呈酸性;说明废液中的溶质为NaCl、CaCl2、HCl【结论与反思】(2)氧化铜是黑色固体粉末,与盐酸反应生成氯化铜和水,可观察到固体溶解,溶液呈蓝色,该反应的化学方程式为CuO + 2HCl = CuCl2 + H2O;【表达与交流】废液呈酸性会导致水或土壤被污染,或管道被腐蚀,所排放前,应先将污水进行处理至中性再排放;

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案