题目内容
(3分)为测定NaCl和Na2SO4固体混合物中NaCl的质量分数,化学小组同学进行如下实验活动:

由此测得原固体混合物中NaCl的质量分数是多少?(已知:Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl)

由此测得原固体混合物中NaCl的质量分数是多少?(已知:Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl)
设样品中氯化钠的质量为y,硫酸钠的质量为z,反应生成氯化钠的质量为x
Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl
142 233 117
z 23.3g x
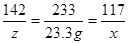
X=11.7g z=14.2g
10%= ×100% y=10.1g
×100% y=10.1g
NaCl%=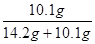 ×100%=41.6%
×100%=41.6%
答:略
Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl
142 233 117
z 23.3g x
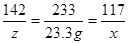
X=11.7g z=14.2g
10%=
 ×100% y=10.1g
×100% y=10.1gNaCl%=
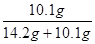 ×100%=41.6%
×100%=41.6%答:略
试题分析:由题意可知,生成的硫酸钡沉淀的质量为23.3g,反应的化学方程式为Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl,利用化学方程式即可求得生成氯化钠的质量和原有硫酸钠的质量;难点是原有氯化钠的质量设为y:已知所得氯化钠溶液质量分数为10%,利用质量守恒定律可得所得溶液的质量为 117g+100g+14.2g—23.3g,溶质为11.7g+y,列式解方程即可求得y;原固体混合物质量即可求得;原固体混合物中NaCl的质量分数即可求得.

练习册系列答案
相关题目







